ไม่สามารถทำการวินิจฉัยที่ถูกต้องได้หากไม่มีการทดสอบเบื้องต้น ข้อมูลที่ได้รับจะช่วยแพทย์ในการวินิจฉัยและช่วยให้มั่นใจว่ามีการกำหนดการรักษาที่ถูกต้อง การทดสอบอย่างหนึ่งคือการเพาะเชื้อแบคทีเรีย นำมาจากวัสดุชีวภาพต่างๆ ในบทความเราจะพิจารณาทุกแง่มุมและคุณลักษณะของขั้นตอนนี้
การเพาะเชื้อแบคทีเรียเป็นที่เข้าใจกันว่าเป็นการศึกษาทางจุลชีววิทยาพิเศษซึ่งดำเนินการในห้องปฏิบัติการ วัสดุชีวภาพถูกนำมาใช้เป็นตัวอย่างทดสอบ ซึ่งผ่านการกรองที่อุณหภูมิหนึ่ง วัตถุประสงค์ของการศึกษาดังกล่าว: เพื่อระบุการมีอยู่ของจุลินทรีย์และเพื่อสร้างจำนวนของจุลินทรีย์ ในอนาคตแพทย์จะสั่งการรักษาตามข้อมูลที่ได้รับ
การวิเคราะห์ทางแบคทีเรียใช้กันอย่างแพร่หลายในด้านเนื้องอกวิทยา นรีเวชวิทยา โสตศอนาสิกวิทยา ศัลยกรรม ระบบทางเดินปัสสาวะ และสาขาอื่นๆ
ข้อบ่งชี้สำหรับการศึกษาทางแบคทีเรียวิทยาคือกระบวนการอักเสบในอวัยวะและระบบของมนุษย์ และสงสัยว่าเป็นภาวะติดเชื้อในกระแสเลือด
สำหรับการวิจัย สามารถใช้วัสดุทางแบคทีเรียต่อไปนี้:
- เสมหะ.
- เมือกจากลำคอ
- เมือกจากท่อปัสสาวะ
- ปัสสาวะ.
- สเปิร์ม
- เต้านม.
- เนื้อหาของซีสต์
- น้ำไขสันหลัง.
- น้ำดี
- เลือด.
- วัสดุออกจากแผล
- เนื้อหาของจุดโฟกัสการอักเสบ
- เมือกจากช่องจมูก
จากสารชีวภาพแต่ละชนิดที่ระบุไว้ มีการหว่านจุลินทรีย์ต่อไปนี้:
- เมือกจากระบบทางเดินปัสสาวะถูกตรวจหา gonococcus, trichomonas, Candida fungi, ureaplasma, Neisseria gonorrhoeae fungi, mycoplasma, Trichomonas vaginalis fungi, listeria จะมีการตรวจเช็คสภาพของแบคทีเรียที่นี่ด้วย
- ตรวจเลือดเพื่อหาความเป็นหมัน
- คอหอยและมูกจมูกได้รับการตรวจสอบสำหรับ Listeria, Haemophilus influenzae, Hemolytic Streptococcus, Meningococcus, Corinobacterium diphtheria, Pneumococcus, Staphylococcus aureus
- การตรวจการปลดปล่อยบาดแผล ช่องที่เป็นหนอง การเจาะทางชีวภาพจะตรวจหา Pseudomonas aeruginosa และ Pseudomonas
- อุจจาระถูกตรวจหา yersinia, ซัลโมเนลลา, แบคทีเรียไทฟอยด์, การติดเชื้อในลำไส้ฉวยโอกาส, อาหารเป็นพิษ อุจจาระยังถูกตรวจสอบสำหรับ dysbacteriosis ในลำไส้
- ละเลง เต้านมตรวจปัสสาวะ ขูด น้ำดี น้ำอสุจิ ของเหลวในข้อ ตรวจหาเชื้อแบคทีเรีย
![]()
ข้อดีและข้อเสียของการเพาะเชื้อแบคทีเรีย
แง่บวกของการเพาะเชื้อแบคทีเรีย ได้แก่ :
- วิธีการนี้ไม่รวมปฏิกิริยาที่ผิดพลาด
- ให้คุณตรวจสอบของเหลวใดๆ ได้อย่างแน่นอน
- ผลการศึกษาทำให้แพทย์สามารถกำหนดวิธีการรักษาที่เหมาะสมได้
ด้านลบรวมถึง:
- ค่อนข้างนานของการศึกษา
- ข้อกำหนดที่สูงมากสำหรับการได้รับวัสดุที่ศึกษา
- ข้อกำหนดที่เข้มงวดสำหรับคุณสมบัติของบุคลากรที่ดำเนินการ การตรวจทางแบคทีเรีย.
วิธีการรวบรวมวัสดุชีวภาพ
คุณภาพของการศึกษาขึ้นอยู่กับความถูกต้องของวัสดุชีวภาพที่เก็บรวบรวมเป็นอย่างมาก ดังนั้นจึงมีกฎเกณฑ์ที่เข้มงวดเกี่ยวกับรั้วโดยที่ไม่สามารถรับข้อมูลที่ถูกต้องเกี่ยวกับสถานะสุขภาพของมนุษย์ได้
- จำเป็นต้องรวบรวมวัสดุด้วยเครื่องมือปลอดเชื้อและวางวัสดุที่รวบรวมไว้ในจานปลอดเชื้อเท่านั้น หากละเลยสิ่งนี้ การรวบรวมวัสดุและการวิจัยเพิ่มเติมจะไม่มีความหมาย
- จำเป็นต้องรวบรวมวัสดุชีวภาพอย่างเคร่งครัดก่อนเริ่มการรักษาด้วยยาปฏิชีวนะ มิฉะนั้นผู้ช่วยห้องปฏิบัติการจะเปิดเผยข้อมูลที่เป็นเท็จ หากวันนี้ผู้ป่วยได้รับการรักษาด้วยยาปฏิชีวนะอยู่แล้ว การศึกษาทางแบคทีเรียวิทยาควรดำเนินการเพียง 10 วันหลังจากสิ้นสุดยาเม็ดสุดท้าย
- เมื่อเก็บปัสสาวะต้องกินตอนกลางในตอนเช้าเท่านั้น ต้องวางปัสสาวะในภาชนะที่ปลอดเชื้อ ปริมาณวัสดุที่เก็บรวบรวมควรเท่ากับ 10-15 มล. นอกจากนี้ อย่าลืมพยายามส่งปัสสาวะไปยังห้องปฏิบัติการภายในเวลาไม่ถึง 2 ชั่วโมงหลังการเก็บ
- ก่อนที่จะเก็บน้ำมูกจากจมูกหรือลำคอ คุณไม่สามารถกิน ดื่ม แปรงฟัน และล้างปากด้วยน้ำยาฆ่าเชื้อ
- ควรเก็บอุจจาระด้วยไม้พายที่ผ่านการฆ่าเชื้อแล้ว เวลารวบรวมคือตอนเช้า จำเป็นต้องพับวัสดุในภาชนะที่ปลอดเชื้อ ปริมาณอุจจาระที่เก็บรวบรวมควรเป็น 15-30 กรัม ใช้เวลาน้อยกว่า 5 ชั่วโมงในการพาเขาไปโรงพยาบาล คุณไม่สามารถทิ้งอุจจาระค้างคืนและแช่แข็งได้
- น้ำนมแม่จะแสดงหลังจากขั้นตอนสุขอนามัยเท่านั้น เมื่อต้องการทำเช่นนี้บริเวณหัวนมและหน้าอกจะถูกล้างด้วยน้ำสะอาดจากนั้นจึงบำบัดด้วยเอทิลแอลกอฮอล์ที่มีความเข้มข้น 70% ถัดไปแสดงนม 15 มล. ซึ่งไม่ได้ใช้สำหรับการวิจัย 5 มล. ถัดไปจะถูกเทลงในภาชนะที่ปลอดเชื้อแล้วส่งไปยังห้องปฏิบัติการ ต้องจัดส่งวัสดุภายในสองชั่วโมง
- เลือดสำหรับการตรวจแบคทีเรียจะถูกนำมาเทียบกับพื้นหลังของอุณหภูมิ สำหรับเด็กปริมาณคือ 5 มล. สำหรับผู้ใหญ่ - 15 มล. ที่นี่เราต้องไม่ลืมว่าไม่มีการสุ่มตัวอย่างในช่วงระยะเวลาของยาปฏิชีวนะ
- มีความจำเป็นต้องเก็บเสมหะในระหว่างการโจมตีของไอที่เริ่มขึ้น เมื่อถึงจุดนี้เมือกจะหลั่งออกจากลำคอ เสมหะจะถูกส่งไปยังห้องปฏิบัติการภายในหนึ่งชั่วโมง
- ในผู้หญิง เนื้อหาจะถูกเก็บรวบรวมหลังจากมีประจำเดือน 14 วัน ผู้หญิงไม่ควรปัสสาวะเป็นเวลา 2 ชั่วโมง และอย่างน้อยหนึ่งเดือนจะต้องผ่านไปหลังจากใช้ยาปฏิชีวนะ เมื่อเก็บอสุจิจากผู้ชาย ไม่ควรปัสสาวะประมาณ 5-6 ชั่วโมงก่อนทำการวิเคราะห์

คุณสมบัติของการวิเคราะห์ทางแบคทีเรีย
วัสดุใด ๆ อยู่ภายใต้การวิจัย แต่ละคนมีลักษณะความประพฤติของตนเอง
วัฒนธรรมเลือด
ในสภาวะปกติเลือดไม่มีเชื้อโรค เป็นไปไม่ได้เลยที่จะระบุสถานะของพวกเขาภายใต้กล้องจุลทรรศน์ ในการระบุจุลินทรีย์ แบคทีเรียจะถูกขยายพันธุ์ในอาหารที่เป็นของเหลวซึ่งมีคุณค่าทางโภชนาการสำหรับพวกมันก่อน จากนั้นตัวอย่างเลือดจะอยู่ในสภาวะที่สร้างขึ้นสำหรับพวกเขา (ที่อุณหภูมิ 37 ° C) จนกว่าการเจริญเติบโตที่มองเห็นได้จะเริ่มขึ้น กระบวนการนี้ใช้เวลา 6 ถึง 18 ชั่วโมง หากตรวจแบคทีเรียที่เติบโตเป็นเวลานานมาก เลือดจะถูกเก็บไว้ในสารอาหารเป็นเวลาหลายวัน เมื่อแบคทีเรียถึงขนาดที่กำหนด จะมองเห็นได้ภายใต้กล้องจุลทรรศน์ ในขั้นต่อไป ปฏิกิริยาเคมีจะดำเนินการกับแบคทีเรียที่ระบุเพื่อระบุชนิดของแบคทีเรียได้อย่างแม่นยำ
วัฒนธรรมปัสสาวะ
ในระหว่างการศึกษา ผู้ช่วยห้องปฏิบัติการจะระบุจุลินทรีย์และกำหนดจำนวนจุลินทรีย์ ค่าการวินิจฉัยคือ 104-105 CFU/มล. หากความเข้มข้นของพวกเขาเกินมาตรฐานพวกเขาก็พูดถึงผลบวกนั่นคือถังเพาะไม่ดี การรักษาในกรณีนี้จะลดลงเหลือเพียงการใช้ยาปฏิชีวนะ ซึ่งมีความไวต่อเชื้อจุลินทรีย์มากที่สุด ในระหว่างการวิเคราะห์ มีหลายกรณีที่การวิเคราะห์ทั่วไปดี บุคคลนั้นไม่มีข้อร้องเรียน และถังเพาะเชื้อแสดง E. coli ในกรณีนี้ เป็นไปได้มากว่าจะไม่เป็นไปตามเงื่อนไขปลอดเชื้อ จึงต้องมีการเก็บรวบรวมและดำเนินการศึกษาซ้ำ
วัฒนธรรมเสมหะ
มีการกำหนดการวิเคราะห์ที่คล้ายกันสำหรับโรคหลอดลมอักเสบบ่อยครั้งและเป็นเวลานาน ผู้ช่วยห้องปฏิบัติการจะกำหนดความไวต่อยาปฏิชีวนะร่วมกับการระบุจุลินทรีย์ที่ทำให้เกิดโรคร่วมกับการระบุจุลินทรีย์ที่ทำให้เกิดโรค ช่วยให้คุณกำหนด .ได้ถูกต้อง การรักษาที่มีประสิทธิภาพ, ลดเวลาการเจ็บป่วยและบรรลุการฟื้นตัวที่จำเป็น

วัฒนธรรมอุจจาระ
อุจจาระจะถูกตรวจสอบที่ต่างๆ การติดเชื้อในลำไส้. ผู้ช่วยห้องปฏิบัติการระบุเชื้อโรคในวัสดุ ในลำไส้ที่แข็งแรง มีจุลินทรีย์ฉวยโอกาสในคุณภาพและปริมาณที่เหมาะสม หากจุลินทรีย์ในลำไส้เปลี่ยนแปลง ตัวบ่งชี้เหล่านี้ก็จะเปลี่ยนไปด้วย ผู้ป่วยบ่นว่าเสียงดัง อุจจาระมีปัญหา ท้องอืด และปวดท้อง หากเกิดการอาเจียนและอุจจาระมีความผิดปกติอย่างรุนแรง ให้นำถังเพาะสำหรับโรค dysbacteriosis
วัฒนธรรมแบคทีเรียของอุจจาระมีการถอดรหัสดังต่อไปนี้:
- ระดับแรก: มีการเปลี่ยนแปลงเล็กน้อยใน microbiocenosis ไม่พบจุลินทรีย์แปลกปลอม
- ระดับที่สอง: ปริมาณของ bifidoflora และ lactoflora เปลี่ยนไปแล้วยังมีการตรวจสอบจำนวนของ Escherichia
- ระดับที่สาม: ในขั้นตอนนี้ lactoflora, bifidoflora จะลดลงอย่างรวดเร็วหรือขาดหายไปอย่างสมบูรณ์ แต่เชื้อราที่มีลักษณะคล้ายยีสต์และ Staphylococci ที่ทำให้เลือดไหลเวียนได้เหนือกว่า
- ระดับที่สี่: ที่นี่ microbiocenosis มีการเปลี่ยนแปลงอย่างมากจำนวนของจุลินทรีย์ที่ทำให้เกิดโรคเพิ่มขึ้นอย่างมาก Proteus ถูกตรวจพบ
ผลลัพธ์ได้รับอิทธิพลอย่างมาก (ในทิศทางที่ผิด) จากการบริโภคพรีไบโอติกและสารต้านจุลชีพ
การเพาะอสุจิ
อุทานจะตรวจหาโรคของบริเวณอวัยวะเพศและสงสัยว่ามีบุตรยากในผู้ชาย การหว่านในถังเผยให้เห็นจุลินทรีย์ที่ทำให้เกิดโรคซึ่งการรักษาหลักจะถูกนำไปใช้ในอนาคต
มีกฎหลายข้อในการฝากถังเพาะ:
- งดการมีเพศสัมพันธ์โดยสมบูรณ์เป็นเวลา 7 วัน
- การห้ามบริโภคผลิตภัณฑ์แอลกอฮอล์อย่างเด็ดขาด 4 วันก่อนการวิเคราะห์
- หากชายคนหนึ่งใช้ยาปฏิชีวนะการหว่านเมล็ดจะถูกกำหนด 2 สัปดาห์หลังจากสิ้นสุดการบริโภค
- จำเป็นต้องเก็บอสุจิในภาชนะที่มีสารอาหารพิเศษ
- ก่อนทำหัตถการคุณต้องฉี่ควรล้างมือด้วยสารต้านเชื้อแบคทีเรียทำห้องน้ำด้วยสบู่ท่อปัสสาวะ จากนั้นเช็ดอวัยวะเพศและศีรษะด้วยผ้าปลอดเชื้อ เก็บอสุจิโดยใช้วิธีการพิเศษที่เรียกว่าการช่วยตัวเอง คุณไม่สามารถสัมผัสภาชนะได้ในขณะนี้ คุณต้องรวบรวมอุทานในตอนเช้า
- สังเกตเวลาการส่งมอบอสุจิอย่างเคร่งครัด: ภายในสามชั่วโมงหลังจากขั้นตอนการรวบรวม หากไม่สามารถส่งวัสดุไปที่โรงพยาบาลตรงเวลาด้วยเหตุผลบางประการก็สามารถนำไปใส่ในตู้เย็นได้สักพัก เวลาที่ใช้อุทานไม่ควรเกิน 24 ชั่วโมง
- หากสเปิร์มได้รับการทดสอบสำหรับมัยโคพลาสมาและยูเรียพลาสมา ขวดที่มีวัสดุนั้นจะถูกวางไว้ในสื่อการขนส่งพิเศษ
- การวิเคราะห์น้ำอสุจิมักจะพร้อมหนึ่งสัปดาห์หลังจากการบริจาค

เพาะพันธุ์ไม้ดอก
นี่คือชื่อของการรวบรวมวัสดุจากช่องคลอด ดำเนินการด้วยเครื่องมืออนุกรมในสถานพยาบาล การรับวัสดุจากช่องคลอดจะไม่ทำให้ผู้หญิงรู้สึกไม่สบายและไม่สบาย อย่างไรก็ตาม ความเจ็บปวดบางอย่างจะทำให้เกิดการสะสมของวัสดุจากท่อปัสสาวะ แต่เพื่อสุขภาพของคุณขั้นตอนนี้จะต้องทน นอกจากนี้คุณต้องเตรียมพร้อมที่จะรู้สึกไม่สบายซ้ำในการถ่ายปัสสาวะครั้งแรกหลังเหตุการณ์ แต่พวกเขาจะปล่อยวางอย่างรวดเร็ว
เมื่อถังปลูกบนพืชแจ้งเกี่ยวกับโรค แพทย์จะสั่งการรักษาที่เหมาะสม หลังจากรับประทานยาแล้วจะมีการหว่านถังที่สองเสมอ จากผลการรักษา แพทย์จะสามารถปรับการรักษาตามที่กำหนดได้
การเพาะเชื้อแบคทีเรียระหว่างตั้งครรภ์
ส่วนใหญ่มักจะใช้ถังเพาะในนรีเวชวิทยา โดยเฉพาะในระหว่างตั้งครรภ์ ตลอดเวลาของการคลอดบุตร ผู้หญิงต้องทำการทดสอบที่จำเป็นหลายครั้ง รายการนี้ยังรวมถึงถังเพาะ แสดงให้หญิงตั้งครรภ์เห็นโดยไม่ล้มเหลว การวิเคราะห์สามารถทำได้ในขั้นตอนการวางแผนของเด็กในครรภ์
ในระหว่างตั้งครรภ์จะตรวจสอบวัสดุทางชีวภาพของคอหอยจมูกและปัสสาวะ การวิเคราะห์ช่วยให้คุณสามารถระบุจุลินทรีย์ที่เป็นอันตรายซึ่งส่งผลเสียต่อพัฒนาการของเด็ก
อย่ากลัวขั้นตอนของตัวเอง วัสดุสำหรับการศึกษานั้นดำเนินการโดยนรีแพทย์อย่างระมัดระวัง
เป็นที่ทราบกันดีว่าการรบกวนในการก่อตัวของทารกในครรภ์สามารถทำให้เกิด trichomonas, staphylococcus aureus, mycoplasmas, chlamydia และ ureaplasma การปรากฏตัวของจุลินทรีย์ดังกล่าวอาจทำให้ทารกในครรภ์เสียชีวิตได้ เชื้อราเช่น Candida กระตุ้นการอักเสบของเนื้อเยื่อซึ่งต่อมาได้รับการแตกร้าวอย่างรุนแรงระหว่างการคลอดบุตร
Bakposev ช่วยให้คุณระบุโรคที่เกิดขึ้นในรูปแบบแฝง พวกเขายังเป็นอันตรายต่อทั้งทารกในครรภ์และสุขภาพของแม่ด้วย หากตรวจพบการรักษาที่จำเป็นจะดำเนินการ ในตอนท้ายแพทย์จะสั่งการตรวจทางแบคทีเรียครั้งที่สอง
ที่ ปรึกษาผู้หญิงตรวจสอบวัฒนธรรมจากจมูกและลำคอ การวิเคราะห์จำเป็นต้องระบุ Staphylococcus aureus ซึ่งเป็นสาเหตุหลักของภาวะติดเชื้อในครรภ์หลังคลอดและโรคเต้านมอักเสบเป็นหนอง หากตรวจพบให้ทำการรักษาก่อนคลอด
การศึกษาปัสสาวะของหญิงตั้งครรภ์ในห้องปฏิบัติการช่วยให้คุณตรวจพบพยาธิสภาพได้ทันท่วงที ในช่วงเวลานี้ทางเดินของปัสสาวะผ่านวิถีธรรมชาติจะหยุดชะงักและสภาวะทั้งหมดจะถูกสร้างขึ้นในร่างกายเพื่อการพัฒนาของจุลินทรีย์ที่เป็นอันตราย การหยุดกระบวนการนี้จะช่วยป้องกัน pyelonephritis ซึ่งมักจะทรมานสตรีมีครรภ์ มีกำหนดเวลาที่แน่นอนสำหรับการส่งมอบถังเพาะเลี้ยงปัสสาวะ นี่คือช่วงเวลาของการลงทะเบียนและสัปดาห์ที่สามสิบหกของการตั้งครรภ์ คุณจะต้องทำการทดสอบอีกหลายครั้งหากผู้หญิงมีข้อบ่งชี้ในเรื่องนี้ เช่น โรคไต เม็ดเลือดขาว และโปรตีนในปัสสาวะ
เทคนิคการเพาะเชื้อแบคทีเรีย
มีหลายเทคนิคด้วยกัน ส่วนใหญ่ดำเนินการโดยใช้เครื่องมือต่อไปนี้:
- วงจุลชีววิทยา
- จานเพาะเชื้อ.
- ห่วงพิเศษพร้อมปิเปต
- ไม้พาย.
- เข็ม.
วงแบคทีเรียทางจุลชีววิทยาเป็นสากลเนื่องจากใช้ในเทคนิคทั้งหมด สำหรับวัสดุที่เป็นของเหลว จะใช้ปิเปตลูป
เครื่องมือสองอย่างสุดท้ายจะใช้เมื่อเพาะในจานเพาะเชื้อ เธอถือว่าพิเศษ ใช้เฉพาะสำหรับการหว่านบนอาหารที่มีความหนาแน่นสูง ถ้วยนี้เป็นภาชนะสำหรับห้องปฏิบัติการรูปทรงแบนพิเศษที่มีความสูงเล็กน้อย มันทำจากโพลีสไตรีนโปร่งใสหรือแก้ว เส้นผ่านศูนย์กลางของจานเพาะเชื้อสามารถเป็น 50-100 มล. ความสูงของมันคือประมาณ 15 มล. เสมอ จานเพาะเชื้อสามารถเป็นสองประเภท: แก้วและพลาสติก อันแรกมีไว้สำหรับใช้ซ้ำได้ และอันที่สองสามารถใช้ได้เพียงครั้งเดียวเท่านั้น ถ้วยพลาสติกปลอดเชื้อมากขึ้น เนื่องจากส่งไปยังห้องปฏิบัติการในบรรจุภัณฑ์ปิดสนิทพิเศษ ถ้วยแก้วผ่านการฆ่าเชื้ออย่างระมัดระวังเสมอก่อนการตรวจทางแบคทีเรีย
Bakposev ได้รับการตรวจสอบในสื่อพิเศษซึ่งสามารถเป็นของแข็งหรือของเหลวได้ หากวัสดุที่เป็นของเหลวเพิ่มขึ้น ผู้ช่วยในห้องปฏิบัติการก็ใช้หลอดทดลอง
เทคนิคการวิจัยทางแบคทีเรียวิทยามีดังนี้ จานเพาะเชื้อเปิดออกเล็กน้อย จากนั้นจึงนำวัสดุชีวภาพไปใช้กับอาหารที่มีความหนาแน่นสูง ต่อไป ให้เริ่มสังเกตการเติบโตของวัสดุนี้ แบคทีเรียเริ่มมีจำนวนเพิ่มขึ้นเรื่อย ๆ กลายเป็นวัฒนธรรมที่เต็มเปี่ยมอย่างหนาแน่น จากนั้นพวกเขาก็เริ่มแบ่งออกเป็นอาณานิคม หลังจากผ่านไปหลายวัน ผู้ช่วยห้องปฏิบัติการจะระบุเชื้อโรค ควบคู่ไปกับการทดสอบความไวต่อยาปฏิชีวนะ

ผลการเพาะ
เมื่อสิ้นสุดการศึกษา ผู้ช่วยห้องปฏิบัติการต้องได้รับการประเมินสองครั้งจากตัวอย่างทดสอบ:
- เชิงคุณภาพ (ไม่ว่าจะมีเชื้อโรคที่น่าสงสัยในวัสดุชีวภาพที่ศึกษาหรือไม่)
- เชิงปริมาณ (สิ่งที่พบความเข้มข้น)
การประเมินคุณภาพจะถูกถอดรหัสโดยใช้อัตราการเติบโต มีเพียงสี่คนเท่านั้น
- ระดับแรก: การเติบโตเล็กน้อยในตัวกลางที่ค่อนข้างเหลว ไม่มีการเติบโตในตัวกลางที่เป็นของแข็ง
- ระดับที่สอง: การเจริญเติบโตเกิดขึ้นบนอาหารที่มีความหนาแน่นสูง (ประมาณ 10 โคโลนี)
- ชั้นประถมศึกษาปีที่ 3: การประเมินการเจริญเติบโตของอาหารแข็ง (10-100 โคโลนี)
- ระดับที่สี่: มากกว่า 100 อาณานิคม
ในกรณีของการพิจารณาพืชฉวยโอกาส สององศาแรกไม่ถือเป็นโรค เป็นไปได้มากว่านี่เป็นการปนเปื้อนตามปกติของวัสดุชีวภาพ ระดับที่สามและสี่ช่วยให้คุณระบุสาเหตุของโรคได้แล้ว
หากการวิเคราะห์พบว่ามีพืชที่ทำให้เกิดโรค ให้พิจารณาระดับทั้งสี่ที่ระบุไว้
ปริมาณเป็นที่ยอมรับตามเงื่อนไขและกำหนดใน CFU ลักษณะเฉพาะ หมายถึง กลุ่มเซลล์แบคทีเรียที่สามารถเติบโตเป็นอาณานิคมได้
โคโลนีและ CFU/มล. มีความสัมพันธ์กันดังนี้:
- 103/มล. นับเป็น 1 โคโลนี;
- 104/มล. 1-5 โคโลนี;
- 105/มล. เจริญเติบโตเพียงพอสำหรับโคโลนี 5-15 ตัว;
- 106/มล. ถือว่ามีโคโลนีมากกว่า 15 ตัว
การหาปริมาณก็มีความสำคัญเช่นเดียวกัน ช่วยในการกำหนดระดับการปนเปื้อนและควบคุมการรักษาที่ทำ
มีเงื่อนไขโดยประมาณสำหรับความพร้อมของผลการหว่าน:
- พืช: 4-7 วัน
- เมือกจากช่องจมูก: 5-7 วัน
- อุจจาระ: 4-7 วัน
- วัสดุเกี่ยวกับอวัยวะสืบพันธุ์: 4-7 วัน
- เลือดเพื่อกำหนดความเป็นหมัน: 10 วัน อย่างไรก็ตาม ในที่นี้เราสามารถบอกผลเบื้องต้นได้ในสามวัน
การเพาะเชื้อแบคทีเรียเป็นขั้นตอนที่สำคัญมากซึ่งให้ข้อมูลที่ดีเกี่ยวกับสาเหตุของโรคในมนุษย์ หากแพทย์กำหนดจะต้องผ่านการวิเคราะห์
นำวัสดุสำหรับการตรวจแบคทีเรียไปใส่ในจานปลอดเชื้อก่อน
การเริ่มต้นของการรักษาด้วยยาปฏิชีวนะ
ส่งมอบตามกำหนดเวลาใน bix โดยไม่มีอุณหภูมิต่ำ
เลือด
สำหรับการเป็นหมัน (จุลินทรีย์, การเพาะในเลือด) ให้ปลอดเชื้อในขณะที่เพิ่มอุณหภูมิลงในสารอาหาร "สองเท่า" ที่ให้ความร้อนถึง 37 ° C ในปริมาณ 10 มล. ในผู้ใหญ่และ 0.1-5 มล. ในเด็ก (ในอัตราส่วน 1:10) ). คนสองคนทำการสุ่มตัวอย่างเลือด: คนหนึ่งปฏิบัติต่อผิวหนังเจาะหลอดเลือดดำและนำเลือดเข้าไปในหลอดฉีดยาคนที่สองเปิดฝาขวดขวดบนเปลวไฟของตะเกียงแอลกอฮอล์แทนที่ด้วยกระแสเลือดจากหลอดฉีดยา , เผาคอขวดหรือหลอดทดลอง, ปิดฝาและทำให้เป็นเนื้อเดียวกันเพื่อไม่ให้เกิดลิ่มเลือด ตามข้อบ่งชี้จะมีการทำสเมียร์บนสไลด์แก้วพร้อม ๆ กัน ให้โดยไม่มีภาวะอุณหภูมิต่ำ ขอแนะนำให้ใช้เลือดในเวลาเดียวกันในสามขวด ในตอนเย็น ตอนกลางคืนและวันอาทิตย์ ให้วางขวดเลือดในเทอร์โมสตัทที่อุณหภูมิ 37 องศาเซลเซียสในห้องปฏิบัติการทางคลินิก
ปัสสาวะ
ปัสสาวะในตอนเช้า (สะสม) เฉลี่ยหลังจากห้องน้ำของอวัยวะสืบพันธุ์ภายนอกถูกนำไปยังจุลินทรีย์ในปริมาณ 3-5 มล. ส่งไม่เกิน 2 ชั่วโมงหากเก็บไว้ในตู้เย็น ด้วยท่อปัสสาวะอักเสบ, กระเพาะปัสสาวะอักเสบ - สุ่มตัวอย่างส่วนแรกของปัสสาวะ
เสมหะ
ก่อนสุ่มตัวอย่าง ให้แปรงฟัน บ้วนปากด้วยน้ำต้มสดหรือน้ำยาฆ่าเชื้อ เก็บเสมหะในตอนเช้า (สะสม) อย่างง่ายดายโดยไม่มีน้ำลายในปริมาณ 1-5 มล. ส่งไม่เกิน 2 ชั่วโมงนับจากเวลาที่รับ
1. ในกรณีเกิดโรค - ด้วยสำลีก้านแยกสำหรับจมูกแต่ละข้าง
แน่นอนจากแผนกลึกหลังจากปล่อยจมูกจากเมือก เมื่อแห้ง
เยื่อเมือก - ชุบสารละลาย NaCl 0.9% ด้วยสำลีก้าน
2. สำหรับการขนส่ง Staphylococcus aureus - จากส่วนหน้าของโพรงจมูก
ด้วยไม้กวาดหนึ่งอันจากจมูกทั้งสองข้างโดยไม่ต้องสัมผัสผิวหนังของจมูก ส่งถึง
ขณะท้องว่างหรือหลังอาหาร 2 ชั่วโมง ให้ดื่มน้ำเปล่า
1. สำหรับโรคคอตีบ - ใช้ไม้พายกับไม้กวาดที่ขอบของสุขภาพและได้รับผลกระทบ
ผ้า พร้อมกันนั้นก็เช็ดไม้กวาดออกจากจมูกทั้งสองข้าง
หากคุณสงสัยว่าเป็นโรคคอตีบ - 2 หรือ 3 swabs จากลำคอเพื่อทำการตรวจแบคทีเรียโดยตรงการทดสอบความเป็นพิษการหว่านเมล็ด ตามข้อบ่งชี้ - รอยเปื้อนจากสถานที่หายาก, คอหอย, จมูก จัดส่งภายใน 2 ชั่วโมงโดยไม่มีอุณหภูมิ ในตอนเย็น เวลากลางคืน ในวันอาทิตย์ ลดวัสดุลงในสภาพแวดล้อมที่อบอุ่นและเก็บในอุณหภูมิ +37 C
2. บนจุลินทรีย์ - ใช้ไม้พายกับสำลีเช็ดด้านขวา
ต่อมทอนซิล, โค้ง, ลิ้นไก่, ต่อมทอนซิลซ้าย, ผนังด้านหลังของคอหอย อย่าจับ
เยื่อบุในช่องปาก ลิ้น! จัดส่งภายใน 2 ชั่วโมงโดยไม่มีอุณหภูมิ
3. สำหรับไข้กาฬนกนางแอ่น - สุ่มตัวอย่างและหว่านเมล็ดข้างเตียงของผู้ป่วยหรือผลิตผลทางห้องปฏิบัติการ
ผู้ช่วยห้องปฏิบัติการ, นักแบคทีเรียวิทยาจากผนังด้านหลังของช่องจมูกด้วยไม้พาย
งอเป็นมุม 45 ใน % ล่างของความยาวกับหลอดทดลอง จัดส่งและ
หว่านทันที!
4. สำหรับโรคไอกรน - ข้างเตียงของผู้ป่วยหรือในห้องปฏิบัติการผู้ช่วยห้องปฏิบัติการผลิตจากด้านหลัง
ผนังคอหอย (ซับน้ำ) ด้วยสำลีก้านโค้งทำมุม 45 องศา จัดส่ง
และหว่านทันทีโดยไม่มีอุณหภูมิ
5. สำหรับโรคติดเชื้อรา - ด้วยสำลีก้านจากบริเวณที่ได้รับผลกระทบจากเยื่อเมือก ส่งถึง
เป็นเวลา 2 ชั่วโมงโดยไม่มีภาวะอุณหภูมิต่ำ
ล้างน้ำของบรอนช์
ในหลอดทดลองปลอดเชื้อ จำนวน 5 มล. จัดส่งภายใน 2 ชั่วโมงโดยไม่มีอุณหภูมิ
LIKVOR
ส่วนสุดท้ายในปริมาณ 1-3 มล. ในหลอดทดลองที่ผ่านการฆ่าเชื้อตามกฎของ asepsis เหนือตะเกียงแอลกอฮอล์ ส่งทันทีในกล่องอุ่นหรือวางที่อุณหภูมิ 37 ในเทอร์โมสตัท
RAS ที่ปลดออกได้
เตรียมผิวรอบ ๆ แผลด้วยน้ำยาฆ่าเชื้อกำจัดมวลเนื้อตายเศษซากหนองด้วยผ้าเช็ดปากที่ปลอดเชื้อ วัสดุนี้ใช้สำลีก้านหมุนเป็นวงกลมจากจุดศูนย์กลางไปยังขอบ ตามข้อบ่งชี้ - 2 swabs หนึ่งอันสำหรับ bactryoscopy ดั้งเดิม
โดย ซิโต้! - 3 swabs สำหรับการตรวจแบคทีเรีย การเพาะเลี้ยง และความไวต่อยาปฏิชีวนะ หากมีการระบายน้ำในแผลให้ใส่สายสวน - ส่วนภายในตัดด้วยกรรไกรหมันแล้วใส่ในขวดที่มีสารอาหาร จัดส่งภายใน 1-2 ชั่วโมงโดยไม่มีภาวะอุณหภูมิต่ำ นอกเวลาทำการของห้องปฏิบัติการ วัสดุจะถูกนำเข้าสู่ตัวกลางเสริมสมรรถนะและเก็บไว้ในตู้ฟักที่อุณหภูมิ 37°C ในห้องปฏิบัติการทางคลินิก
คะแนน เนื้อหาเกี่ยวกับ ANAEROBE บาดแผลลึกที่ถอดออกได้ ชิ้นผ้า
วัสดุพื้นเมืองในหลอดฉีดยาจำนวน 0.5-3 มล. ที่ปลายเข็ม - หลอดทดลองยางห่อด้วย ผ้าเช็ดปากปลอดเชื้อ, ภายใน 0.5-2 ชั่วโมง เนื้อเยื่อของเนื้อเยื่อวัสดุพื้นเมืองจำนวน 0.5-3 มล. ใส่ในขวดที่ปราศจากเชื้อหลอดทดลอง จัดส่งภายใน 2 ชม. หรือด้วย thioglycol medium - จัดส่งภายใน 12-24 ชม.
ตา
5-6 ชั่วโมงก่อนการรวบรวม ยกเลิกขั้นตอนและยาทั้งหมด เยื่อบุตา - ด้วยสำลีก้านที่มีเมือกจากด้านนอกถึงขอบด้านในโดยไม่ต้องสัมผัสผิวหนังแยกจากตาแต่ละข้าง
ความลับของถุงน้ำตา - หลังจากการนวดถูกแยกออกด้วยสำลีก้าน
ขอบเปลือกตา - ลอกเปลือกตาออก ใช้สำลีเช็ดจากแผลที่โคนขนตา หรือดึงขนตาสองสามอันแล้วจุ่มลงในสารอาหาร จัดส่งภายใน 2 ชั่วโมงโดยไม่มีอุณหภูมิ
อวัยวะเพศ
ช่อง "C" - ด้วยสำลีก้านในกระจกก่อนการตรวจด้วยตนเอง โดยก่อนหน้านี้ทำการรักษาส่วนที่เกี่ยวกับโยนีด้วยสำลีชุบน้ำเกลือโดยไม่ต้องสัมผัสผนังช่องคลอด
ช่องคลอด - ก่อนการตรวจด้วยตนเอง หลังจากแนะนำกระจกและลิฟต์ ให้ใช้สำลีก้านจากบริเวณที่มีการเปลี่ยนแปลงทางพยาธิวิทยา
มดลูก อวัยวะของมดลูก - ระหว่างการผ่าตัด นำ exudate ชิ้นส่วนของอวัยวะลงในขวดหรือหลอดทดลองที่มีสารอาหาร
ท่อปัสสาวะที่ถอดออกได้ - หลังห้องน้ำของอวัยวะสืบพันธุ์ภายนอกใช้สำลีก้านโดยไม่ต้องสัมผัสผิวหนัง ส่งในเชเชน 1-2 ชั่วโมงโดยไม่มีอุณหภูมิ
ตามข้อบ่งชี้ ควบคู่ไปกับการนำวัสดุไปใช้ นรีแพทย์ (ผู้เชี่ยวชาญด้านระบบทางเดินปัสสาวะ) เตรียมรอยเปื้อนบนสไลด์แก้วโดยใช้สำลีก้านหรือเครื่องมือทางนรีเวชที่แยกจากกัน กระจายวัสดุอย่างสม่ำเสมอโดยไม่ต้องถูหยาบและการเคลื่อนไหวที่เฉียบคม
เกี่ยวกับยูเรียพลาสโมซิส
โดยไม่ใช้ยาปฏิชีวนะเป็นเวลา 2 สัปดาห์ ก่อนการยั่วยุ
สำหรับผู้ชาย:
จากท่อปัสสาวะห้ามปัสสาวะเป็นเวลา 4-6 ชั่วโมงรักษาอวัยวะเพศลึงค์ด้วยสำลีหมันชุบสารละลาย NuCl 0.8% ในบริเวณช่องเปิดภายนอก นำสารคัดหลั่งหยดแรกออกแล้วหว่านเมล็ดที่ตามมา หากไม่มีการปล่อยให้ขูดด้วยช้อน Volkmann ให้ลึก 2-3 ซม. ปัสสาวะครั้งแรก 10 มล. หว่านตะกอน
ในหมู่ผู้หญิง:
จากท่อปัสสาวะหลังการนวดผ่านช่องคลอดด้วยช้อน Volkmann ขูดเป็นสารอาหาร
จากช่อง "C" ส่วนหลังของช่องคลอดหลังการรักษาด้วยสำลีที่ผ่านการฆ่าเชื้อแล้วชุบด้วยสารละลาย NaCl 0.8% ที่ผ่านการฆ่าเชื้อแล้วขูดด้วยช้อน Volkmann
สารอาหารหลังหยอดเมล็ดควรถูกส่งไปยังห้องปฏิบัติการภายใน 1 ชั่วโมงหรือวางไว้ที่อุณหภูมิ 37 ° C ในเทอร์โมสตัท
BILE
เมื่อตรวจน้ำดีไปที่ห้องปฏิบัติการทางคลินิก ให้แยกส่วน A, B, C ออกเป็น 3 หลอดทดลองที่ปลอดเชื้อจำนวน 2-5 มล. หรือระหว่างการผ่าตัดโดยใช้หลอดฉีดยาเข้าไปในหลอดทดลองโดยปฏิบัติตามกฎของ asepsis ส่งภายใน 2 ชม.
เต้านม
ด้วยการปฏิบัติตามกฎของ asepsis หลังจากเข้าห้องน้ำของต่อมน้ำนมหลังจากหยดแรกลงในผ้าเช็ดปาก ส่งในปริมาณ 1-3 มล. ในขวดที่ปราศจากเชื้อภายใน 0.5-1 ชั่วโมง
กรณีหูชั้นนอกเสียหาย ให้ปรนนิบัติผิวด้วยแอลกอฮอล์ 70 แอลกอฮอล์ ตามด้วยล้างด้วยน้ำเกลือ จากนั้นจึงเก็บสารคัดหลั่งออกจากจุดโฟกัสด้วยสำลีก้าน จัดส่งภายใน 2 ชั่วโมงโดยไม่มีอุณหภูมิ
ในกรณีที่เกิดความเสียหายต่อหูชั้นกลาง หูชั้นใน รอยเจาะ และวัสดุที่ได้รับระหว่างการผ่าตัด เก็บในจานปลอดเชื้อหรือสารอาหาร (นอกเวลาห้องปฏิบัติการ)
1. สำหรับโรคบิด - ส่วนแรก สำหรับเชื้อซัลโมเนลลา - ส่วนสุดท้าย หรือ
จากเรืออย่างไร้ร่องรอย สารละลายในปริมาณ 0.5-1 กรัมในหลอดทดลองด้วย
สารกันบูดกลีเซอรีน (เก็บในตู้เย็นตั้งแต่ใช้เวลาถึง12
ชั่วโมง) หรือในภาชนะที่ปลอดเชื้อ ส่งภายใน 2 ชม.
2. สำหรับอหิวาตกโรค - 0.5-1.5 กรัมของสารกันบูดพื้นเมืองหรืออหิวาตกโรค
3. สำหรับ dysbacteriosis เชื้อรา Staphylococcus aureus ที่ทำให้เกิดโรค UPM (ฉวยโอกาส
จุลินทรีย์) อุจจาระพื้นเมือง 1-2 กรัมในขวดปลอดเชื้อตาม
กฎการติดเชื้อ จัดส่งภายใน 2 ชั่วโมงโดยไม่มีอุณหภูมิ
วิธีการทางแบคทีเรีย - การแยกวัฒนธรรมบริสุทธิ์ของจุลินทรีย์และการจำแนกที่ตามมา - มีความสำคัญอย่างยิ่งในการวินิจฉัยโรคติดเชื้อในการศึกษาสถานะสุขอนามัยและสุขอนามัยของวัตถุสิ่งแวดล้อม (น้ำ, อากาศ, ดิน, อาหาร) อย่างไรก็ตาม ขั้นตอนแรกในเทคนิคนี้คือ การเพาะหรือฉีดซ้ำของการเพาะเชื้อแบคทีเรียบนอาหารประเภทต่างๆ วัสดุสำหรับหว่านเมล็ดสามารถเพาะเลี้ยงแบคทีเรีย ขับถ่ายสัตว์และมนุษย์ต่าง ๆ เนื้อเยื่อของศพ น้ำ ดิน และอาหาร วัสดุที่เป็นของเหลวสำหรับการหว่านเมล็ดจะใช้ห่วงหรือปิเปต เมื่อถ่ายโดยลูป ของเหลวควรสร้างฟิล์มใสบาง ๆ ในวงแหวนของวงแหวน - "กระจก" ปิเปตจะใช้เมื่อมีการฉีดวัคซีนวัสดุในปริมาณมากหรือวัดได้อย่างแม่นยำ วิธีการใช้วัสดุที่มีความหนาแน่นสูงนั้นพิจารณาจากความสม่ำเสมอ เมื่อหว่านเมล็ดมักใช้ห่วงแบคทีเรีย การจัดการทั้งหมดที่เกี่ยวข้องกับการหว่านและการแยกวัฒนธรรมจุลินทรีย์จะดำเนินการโดยใช้เปลวไฟ ลูปแบคทีเรียจะจุดไฟบนเปลวไฟทันทีก่อนนำวัสดุ จากนั้นลูปจะเย็นลง เมื่อต้องการทำเช่นนี้ เมื่อทำการเพาะเชื้อจุลินทรีย์จากหลอดทดลอง วงจรร้อนจะถูกจุ่มลงในของเหลวที่ควบแน่น และเมื่อทำการเพาะจากจานเพาะเชื้อ พวกมันจะสัมผัสพื้นผิวของสารอาหารที่ปราศจากการเจริญเติบโตของจุลินทรีย์ วงจรที่ระบายความร้อนอย่างเพียงพอจะไม่ทำให้ของเหลวควบแน่นเกิดฟองและไม่ละลายวุ้นเมื่อสัมผัสกับตัวกลาง หลังจากการหว่านเสร็จสิ้น วงจะถูกเผาอีกครั้งเพื่อทำลายวัฒนธรรมจุลินทรีย์ที่อยู่บนนั้นหรือวัสดุที่ติดเชื้อจุลินทรีย์ ปิเปตและไม้พายใช้สำหรับการหว่านและจุ่มลงในสารละลายฆ่าเชื้อ หลังจากหว่านบนจานเพาะเชื้อจากด้านล่างบนหลอดทดลองในส่วนบนที่สามจะมีการจารึกชื่อของวัสดุที่เพาะจำนวนการวิเคราะห์และวันที่ของการหว่านเมล็ด
เทคนิคการปลูกพืชโดยใช้สารอาหารที่เป็นของแข็งและของเหลว: 1. เมื่อหว่านในอาหารที่เป็นของเหลว ห่วงกับวัสดุที่อยู่บนนั้นจะถูกจุ่มลงในอาหาร ถ้าวัสดุมีความหนืดและไม่หลุดออกจากห่วงก็
รูปที่ 11 แผนการถ่ายโอนจุลินทรีย์จากหลอดทดลองไปยังหลอดทดลอง
ถูบนผนังของภาชนะแล้วล้างออกด้วยของเหลว วัสดุของเหลวที่เก็บรวบรวมในปาสเตอร์หรือปิเปตที่สำเร็จการศึกษาแล้วจะถูกเทลงในอาหารที่มีสารอาหาร 2. เมื่อหว่านบนวุ้นเนื้อเปปโตนที่เอียงหลอดจะถูกถ่ายด้วยมือซ้ายระหว่างนิ้วที่ 1 และ 2 เพื่อให้ฐานของหลอดอยู่บนพื้นผิวของมือและการฉีดวัคซีนจะดำเนินการภายใต้การควบคุมของ ดวงตา. ไม้ก๊อกจะถูกลบออกจากหลอดทดลองด้วยมือขวา V และนิ้ว IV โดยไม่ต้องสัมผัสส่วนของจุกที่เข้าไปในหลอดทดลอง นิ้วที่เหลืออีก 3 นิ้วของมือขวายังคงว่างเพื่อจับแบคทีเรีย ผ่านการเพาะเมล็ด ห่วงถือเหมือนปากกาเขียน หลังจากถอดจุกหลอดทดลองแล้ว หลอดทดลองที่มีสารอาหารจะอยู่ในตำแหน่งเอียงเพื่อป้องกันไม่ให้จุลินทรีย์แปลกปลอมเข้าไปในอากาศ ใส่ห่วงที่มีวัสดุฉีดวัคซีนเข้าไปในหลอดทดลองลงไปที่ด้านล่าง โดยลดระดับราบลงบนพื้นผิวของสารอาหารและใช้จังหวะการเลื่อนจากด้านล่างขึ้นบน จากผนังด้านหนึ่งของหลอดทดลองไปยังอีกผนังหนึ่ง ( รูปที่.).
3. เมื่อหว่านบนพื้นผิวของสารอาหารที่มีความหนาแน่นสูงในจานเพาะเชื้อ ถ้วยจะอยู่ในมือซ้าย ข้างหนึ่งจับก้นด้วยนิ้ว 1 และ II และอีกข้างใช้นิ้ว IV และ V ฝาแง้มเพื่อให้วงหรือไม้พายสามารถผ่านเข้าไปในช่องว่างได้อย่างอิสระได้รับการแก้ไขด้วยนิ้ว 1 และ III หรือ 1 และ II (รูปที่) ไม่ จำนวนมากของของวัสดุที่ใช้ทดสอบนั้นถูด้วยห่วงแบคทีเรียเข้าไปในพื้นผิวของสารอาหารที่ขอบจาน จากนั้นวงจะถูกเผาเพื่อทำลายวัสดุส่วนเกิน แนวหว่านเริ่มต้นจากที่ซึ่งวัสดุตั้งอยู่ ห่วงแบคทีเรียถูกวางราบบนอาหารเพื่อไม่ให้เกิดรอยขีดข่วนบนพื้นผิว และทำลายเส้นให้ทั่วทั้งอาหารหรือในส่วนต่างๆ โดยเริ่มจากการตัดก้นจานก่อน (โดยที่สื่อโปร่งแสง) ออกเป็นหลายส่วนเท่าๆ กัน . จำเป็นต้องพยายามเพื่อให้จังหวะที่ใช้โดยลูปอยู่ใกล้กันมากที่สุดเนื่องจากจะทำให้แนวหว่านทั่วไปยาวขึ้นและทำให้สามารถกระจายวัสดุที่ได้รับการฉีดวัคซีนอย่างสม่ำเสมอบนพื้นผิวของสารอาหารที่มีความหนาแน่นสูงแทน สามารถใช้ไม้กวาดหรือไม้พายได้

ข้าว. 12. การหว่านสารอาหารที่เป็นของแข็งในจานเพาะเชื้อ
ด้วยจุลินทรีย์จำนวนมากในวัสดุที่หว่าน พวกมันเติบโตในรูปแบบของฟิล์มที่ครอบคลุมพื้นผิวทั้งหมดของสารอาหาร ลักษณะการเจริญเติบโตของจุลินทรีย์นี้เรียกว่าต่อเนื่องหรือสนามหญ้า การเพาะเมล็ดในสนามหญ้าทำได้เมื่อจำเป็นต้องได้รับการเพาะเลี้ยงจุลินทรีย์ในปริมาณมากของหนึ่งสายพันธุ์ 4. เตรียมสารแขวนลอยจากวัสดุที่จะฉีดวัคซีนในความหนาของสารอาหารที่มีความหนาแน่นสูงในน้ำประปาที่ปราศจากเชื้อหรือในสารละลายไอโซโทนิก รวบรวมสารแขวนลอย 0.1-1 มล. ลงในปิเปต (ขึ้นอยู่กับระดับการปนเปื้อนของจุลินทรีย์ที่คาดไว้) และเทลงในจานเพาะเชื้อที่ว่างเปล่า หลังจากนี้ถ้วยจะเต็มไปด้วยวุ้นเนื้อเปปโทน 15-20 มล. ละลายและทำให้เย็นลงที่อุณหภูมิ 40-45 ° C (ที่อุณหภูมินี้หลอดทดลองที่มีสื่อใช้กับแก้มไม่ควรทำให้เกิดแผลไหม้ ความรู้สึก) สำหรับการกระจายตัวของวัสดุทดสอบในอาหารที่มีสารอาหารอย่างสม่ำเสมอ ถ้วยปิดที่มีสารอยู่จะหมุนเล็กน้อยบนพื้นผิวของโต๊ะ 5. การหว่านโดยการฉีดลงในคอลัมน์ของสารอาหารจะดำเนินการในหลอดทดลองที่มีสื่อแช่แข็งในรูปของคอลัมน์ หลอดถูกถ่ายด้วยมือซ้ายตามปกติและตรงกลางคอลัมน์ที่ด้านล่างของท่อจะมีการฉีดวัสดุเข้าไปที่ห่วง
การได้มาซึ่งวัฒนธรรมอันบริสุทธิ์ การเพาะเลี้ยงจุลินทรีย์ที่บริสุทธิ์คือประชากรของจุลินทรีย์ในสปีชีส์เดียวกันที่ได้มาจากอาณานิคมของจุลินทรีย์ที่แยกได้ โดยจุลินทรีย์อาณานิคมหมายถึงลูกหลานของแบคทีเรียที่เกิดจากการเพิ่มจำนวนของเซลล์จุลินทรีย์หนึ่งเซลล์ การแยกเชื้อจุลินทรีย์บริสุทธิ์เป็นขั้นตอนบังคับในการศึกษาแบคทีเรีย วัฒนธรรมบริสุทธิ์เป็นสิ่งจำเป็นสำหรับการศึกษาคุณสมบัติทางสัณฐานวิทยา วัฒนธรรม วัฒนธรรม ชีวเคมี และแอนติเจน ซึ่งทั้งหมดเป็นตัวกำหนดชนิดของจุลินทรีย์ภายใต้การศึกษา
มีการเสนอวิธีการต่างๆ มากมายสำหรับการแยกเชื้อจุลินทรีย์บริสุทธิ์ออกจากวัสดุที่มีจุลินทรีย์ผสมอยู่มาก วิธีที่ใช้กันอย่างแพร่หลายมากที่สุดคือการแยกทางกลของจุลินทรีย์ที่มีอยู่ในวัสดุทดสอบ เพื่อให้ได้โคโลนีที่แยกได้บนพื้นผิวหรือในระดับความลึกของสารอาหาร สารอาหารทางเลือกถูกนำมาใช้กันอย่างแพร่หลาย กระตุ้นการพัฒนาของจุลินทรีย์เหล่านั้น วัฒนธรรมที่บริสุทธิ์ควรจะถูกแยกออก จุลินทรีย์บางชนิดมีความไวสูงต่อปัจจัยแวดล้อมบางอย่าง ความต้านทานแต่ละอย่างของจุลินทรีย์ต่อปัจจัยหนึ่งหรืออย่างอื่นถูกใช้เพื่อพัฒนาวิธีการสำหรับการแยกวัฒนธรรมที่บริสุทธิ์โดยการฆ่าจุลินทรีย์ที่มาพร้อมกัน วิธีนี้ใช้เพื่อแยกรูปแบบสปอร์ของจุลินทรีย์ที่ต้านทานต่อ อุณหภูมิสูง, Mycobacterium tuberculosis, ไม่แยแสกับการกระทำของสารละลายเข้มข้นของกรดแร่ซึ่งแตกต่างจากจุลินทรีย์อื่น ๆ ที่มีอยู่ในเสมหะ เมื่อแยกวัฒนธรรมที่บริสุทธิ์ของจุลินทรีย์ที่ทำให้เกิดโรคออกจากวัสดุทางพยาธิวิทยาที่ปนเปื้อนด้วยจุลินทรีย์จากภายนอก บางครั้งพวกมันก็หันไปใช้สัตว์ทดลองที่ติดเชื้อซึ่งไวต่อชนิดของจุลินทรีย์ที่ควรแยกจากวัสดุที่ทำการศึกษา วิธีการทางชีวภาพในการแยกวัฒนธรรมบริสุทธิ์นั้นใช้ในการศึกษาเสมหะสำหรับเนื้อหาของ pneumococci, Mycobacterium tuberculosis มีวิธีการค่อนข้างน้อยในการแยกแบคทีเรียออกเป็นวัฒนธรรมบริสุทธิ์ วิธีนี้ทำได้บ่อยที่สุดโดยการแยกเซลล์แต่ละเซลล์บนอาหารเลี้ยงเชื้อที่เป็นของแข็งโดยใช้วิธีการเพาะพันธุ์สตรีค
จากวัฒนธรรมบริสุทธิ์ อาณานิคมเดียวกันมักจะเติบโต และเซลล์ที่คล้ายกันจะถูกตรวจพบโดยกล้องจุลทรรศน์ โดยเฉพาะอย่างยิ่งในขนาดและคราบแกรม อย่างไรก็ตาม อาจมีข้อยกเว้น ตัวอย่างเช่น อาณานิคมที่เติบโตจากวัฒนธรรมบริสุทธิ์อาจเป็นแบบเรียบ (S) และแบบหยาบ (R) นอกจากนี้เซลล์ coccoid ซีสต์และสปอร์อาจปรากฏในวัฒนธรรมบริสุทธิ์ของจุลินทรีย์ต่างๆ ในที่สุด จุลินทรีย์บางชนิดแสดงความแปรปรวนแกรม หว่านโรคหลอดเลือดสมอง มีหลายวิธีในการแยกแผ่นสื่อที่เป็นของแข็ง ("แผ่นลาย") แต่มีเพียงไม่กี่วิธีเท่านั้นที่ให้อาณานิคมที่แยกออกมาอย่างดีแม้ในกรณีที่ไม่มีทักษะในการทดลอง นอกจากนี้ยังสามารถเทสารละลายวัฒนธรรมผสมที่เจือจางลงบนพื้นผิวของสื่อที่เป็นของแข็งในจานได้ เมื่อทำงานกับแบบไม่ใช้ออกซิเจน "จานลาย" หรือจานที่มีการเพาะเชื้อของเหลวในบรรยากาศอากาศจะถูกฟักในบอลลูนแบบไม่ใช้ออกซิเจน Anaerobes ต้องการสื่อที่เตรียมสดใหม่และควรเป็นริ้วภายใน 4 ชั่วโมงแรกหลังจากการนึ่งฆ่าเชื้อเพื่อหลีกเลี่ยงการสะสมของออกซิเจนที่ละลายในน้ำ
รูปที่ 13 วิธีที่สะดวกสำหรับสตรีคเพลทสำหรับโคโลนีเดี่ยว A. สำหรับการทำเครื่องหมายที่ด้านหลังของจานเพาะเชื้อจะใช้ตัวอักษร T ด้วยดินสอโดยแบ่งด้านล่างออกเป็น 3 ส่วน ข. วงจรการเพาะเลี้ยงซิกแซกถูกลายลงบนพื้นผิวของวุ้นในส่วนที่ 1 ดังแสดงในรูป เมื่อต้องการทำเช่นนี้ ฝาถ้วยจะถูกยกขึ้นก่อน และหลังจากใช้จังหวะ จะปิดทันที ห่วงถูกฆ่าเชื้อด้วยเปลวไฟและปล่อยให้เย็น (15 วินาที) C. วาดวงบนพื้นผิวของตัวกลางในส่วนที่ 1 ดังแสดงในรูป จากนั้นใช้จังหวะกับมันในรูปแบบซิกแซกทันทีบนพื้นผิวของตัวกลางในส่วนที่ 2 อุ่นวงในเปลวไฟและปล่อยให้ ให้เย็น ง. วาดวงบนพื้นผิวของตัวกลางในส่วนที่ 2 ดังที่แสดง แล้วใช้จังหวะซิกแซกบนพื้นผิวของตัวกลางในส่วนที่ 3 พื้นผิววุ้น อาณานิคมจำนวนมากเติบโตในภาคที่ 1 ในขณะที่อาณานิคมที่แยกตัวออกมาดีแต่ละแห่งปรากฏในภาคที่ 2 และ 3
ได้วัฒนธรรมที่บริสุทธิ์โดยการกรองในระดับความลึกของตัวกลาง (ตาม Koch) ใส่หลอดทดลองสามหลอดที่มีส่วนผสมเปปโตนเนื้อ 15 มล. ลงในอ่างน้ำเพื่อละลายวุ้น ตัวกลางที่หลอมละลายจะถูกทำให้เย็นลงที่อุณหภูมิ 43-45°C นำวัสดุทดสอบหนึ่งวงของแบคทีเรียเข้าไปในหลอดทดลอง เพื่อการผสมวัสดุกับสื่อได้ดีขึ้น หลอดที่ฉีดวัคซีนจะหมุนหลายครั้งโดยจับไว้ระหว่างฝ่ามือ หลังจากนั้น เนื้อหาของหลอดทดลองที่ 1 จะถูกถ่ายโอนด้วยลูปที่เผาและทำให้เย็นลงในส่วนที่ 2 และในลักษณะเดียวกันตั้งแต่วันที่ 2 ถึงวันที่ 3 จุลินทรีย์เจือจางที่เตรียมไว้จะถูกเทจากหลอดทดลองลงในจานเพาะเชื้อที่ผ่านการฆ่าเชื้อแล้ว โดยมีหมายเลขกำกับด้วยตัวเลขของหลอดทดลอง หลังจากที่สื่อที่มีวัสดุทดสอบแข็งตัวแล้ว ถ้วยจะถูกวางในเทอร์โมสตัท จำนวนโคโลนีในจานเพาะเลี้ยงจะลดลงเมื่อวัสดุถูกทำให้เจือจาง
การแยกวัฒนธรรมบริสุทธิ์ตามวิธี Drygalsky สารอาหารที่หลอมละลายจะถูกเทลงในจานเพาะเชื้อสามจาน สื่อที่แช่แข็งจะต้องทำให้แห้งเนื่องจากพื้นผิวที่ชื้นมีส่วนทำให้เกิดการเจริญเติบโตที่ไหลมารวมกัน วัสดุทดสอบหนึ่งหยดจะถูกเติมลงในถ้วยแรกและถูลงบนพื้นผิวของสารอาหารด้วยไม้พายที่ผ่านการฆ่าเชื้อ นอกจากนี้โดยไม่ต้องเผาไม้พายและไม่ได้รับวัสดุใหม่ไม้พายจะถูกถ่ายโอนไปยังถ้วยที่สองและสามโดยถูวัสดุที่เหลืออยู่บนพื้นผิวของสารอาหาร วิธีการกรองพื้นผิวที่เสนอโดย Drygalsky เป็นวิธีที่ใช้กันมากที่สุดเพื่อให้ได้จุลินทรีย์บริสุทธิ์ คุณสามารถใช้ไม้พายแทนไม้พายได้ วัสดุบนสารอาหารจะกระจายเป็นจังหวะคู่ขนานทั่วทั้งถ้วยในทิศทางเดียว จากนั้นหมุนถ้วย 180° วาดเส้นไปในทิศทางตั้งฉากกับจังหวะแรก ด้วยวิธีหว่านเมล็ดนี้ วัสดุบนห่วงจะถูกบริโภคทีละน้อย และอาณานิคมที่แยกได้ของจุลินทรีย์จะเติบโตไปตามเส้นกริดที่ใช้เมื่อสิ้นสุดการหว่าน
การศึกษาคุณสมบัติทางวัฒนธรรมของจุลชีพ
ลักษณะทางวัฒนธรรมของจุลินทรีย์ถูกกำหนดโดยธรรมชาติของการเจริญเติบโตของจุลินทรีย์บนอาหาร จุลินทรีย์แต่ละชนิดมีความคงตัวอยู่เสมอ จึงเป็นคุณลักษณะในการวินิจฉัยที่สำคัญ
การเจริญเติบโตของจุลินทรีย์บนอาหารที่เป็นของแข็งเพื่อศึกษาคุณสมบัติของโคโลนี จุลินทรีย์จะถูกเพาะเลี้ยงบนอาหารเลี้ยงเชื้อที่มีความหนาแน่นสูงในจานเพาะเชื้อ เมื่อหว่านวัสดุพวกเขาพยายามทำให้อาณานิคมเติบโตอย่างโดดเดี่ยว แผ่นเพาะเมล็ดจะถูกดูด้วยตาเปล่าหรือผ่านแว่นขยายก่อน จากนั้นจึงวางคว่ำลงบนแท่นกล้องจุลทรรศน์ และมองดูโคโลนีในแสงที่ส่องผ่านด้วยเลนส์กำลังขยายต่ำและรูรับแสงที่แคบ โคโลนีมีลักษณะเฉพาะตามขนาด รูปร่าง เส้นขอบ นูน พื้นผิว สี โครงสร้าง และความสม่ำเสมอ ขนาดอาณานิคม กำหนดโดยเส้นผ่านศูนย์กลาง โคโลนีมีความโดดเด่นตามเส้นผ่านศูนย์กลาง (เส้นผ่านศูนย์กลางน้อยกว่า 1 มม.) ขนาดเล็ก (เส้นผ่านศูนย์กลาง 1-2 มม.) ขนาดกลาง (เส้นผ่านศูนย์กลาง 2-4 มม.) และขนาดใหญ่ (เส้นผ่านศูนย์กลาง 4-6 มม. ขึ้นไป) ทั้งนี้ขึ้นอยู่กับเส้นผ่านศูนย์กลาง รูปร่างอาณานิคม บางครั้งถูกต้อง - กลม, ผิดปกติ - อะมีบา, เหง้า - มีรูปร่างเหมือนราก, คล้ายรากไม้ที่พันกัน ตัวอักษรเส้นขอบ กำหนดโดยการตรวจสอบอาณานิคมภายใต้แว่นขยายหรือกล้องจุลทรรศน์ที่มีกำลังขยายต่ำ แยกแยะระหว่างขอบเรียบในรูปแบบของเส้นที่กำหนดไว้อย่างชัดเจนและไม่สม่ำเสมอ หลังแบ่งออกเป็น:
ขอบสแกลลอปประกอบด้วยฟันขนาดใหญ่โค้งมนเล็กน้อยหรือแบนในรูปแบบที่ถูกต้อง
ขอบหยักซึ่งค่อนข้างแตกต่างจากขอบสแกลลอปที่ฟันขนาดใหญ่ไม่ชัดเจน
ขอบกัดเซาะหรือหยักประกอบด้วยฟันแหลมที่มีขนาดและรูปร่างต่างกัน
ขอบฝอยกับวิลลี่ที่ละเอียดอ่อน
ในบางกรณี ไม่มีเส้นแบ่งเขตอย่างชัดเจนจากพื้นผิวของตัวกลาง ขอบของอาณานิคมนี้เรียกว่าคลุมเครือ ความโล่งใจของอาณานิคม โดดเด่นด้วยระดับความสูงเหนือพื้นผิวของสารอาหารและรูปร่างของแบบฟอร์มในส่วนแนวตั้ง ความโล่งใจของอาณานิคมถูกกำหนดด้วยตาเปล่าหรือด้วยแว่นขยายเมื่อมองจากด้านบนและจากด้านข้าง

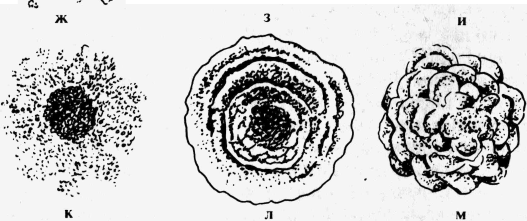
รูปที่ 14 รูปร่างของอาณานิคม:
รอบๆ; b - กลมมีขอบสแกลลอป ใน- กลมด้วยลูกกลิ้งตามขอบ d, d -เหง้า; e - กลมมีขอบเหง้า; g - อะมีบา; h - filiform; และ - พับ; k - ผิด; l- ศูนย์กลาง; ม. - คอมเพล็กซ์
แยกแยะ: 1) โคโลนีทรงหยดน้ำและทรงโดมของโคโลนีที่ถูกต้อง ทรงกลมด้วยระดับความนูนที่แตกต่างกัน ซึ่งในแนวตั้งแสดงถึงส่วนของลูกบอลและแตกต่างกันเฉพาะในความยาวของรัศมี โคโลนีนูนเล็กน้อยและมีรัศมีกว้าง โดม - เล็กกว่า;
2) โคโลนีเป็นพลาโนนูนที่มียอดแบนลาดเบา ๆ หรือขอบแตกอย่างกะทันหัน มีรูปร่างสี่เหลี่ยมคางหมูในแนวตั้ง
3) โคโลนีรูปกรวยมีรูปสามเหลี่ยมในแนวตั้ง:
4) โคโลนีที่มีส่วนตรงกลางยกขึ้นในรูปแบบของหัวนมและลูกกลิ้งตามแนวขอบ
5) อาณานิคมที่มีศูนย์หดหู่
6) โคโลนีแบนราบคืบคลานไปตามพื้นผิวของตัวกลาง ตรวจสอบพื้นผิวของอาณานิคมด้วยแว่นขยายหรือภายใต้กล้องจุลทรรศน์ที่กำลังขยายต่ำ พื้นผิวของโคโลนีเป็นด้านหรือเงาด้วยความมัน แห้งหรือเปียก เรียบหรือหยาบ โคโลนีที่เรียบถูกกำหนดด้วยตัวอักษร S (เรียบ) หยาบ - ด้วยตัวอักษร R (หยาบ) ซึ่งหมายถึง "เรียบ" และ "หยาบ" ตามลำดับ กลไกของการก่อตัวของโคโลนีในรูปแบบเรียบและหยาบนั้นเกิดจากความแตกต่างในกระบวนการแบ่งเซลล์ เซลล์จุลินทรีย์ในโคโลนีรูป S ตั้งอยู่ โดยสัมผัสพื้นผิวด้านข้าง เซลล์รูป R รักษาสะพานไซโตพลาสมิกไว้ในระหว่างการแบ่งตัว สร้างสายโซ่ที่ทับซ้อนกัน ทำให้เกิดพื้นผิวที่ขรุขระ และขอบของอาณานิคมไม่เท่ากัน
สังเกตการเปลี่ยนรูป S ไปเป็นรูปแบบ R ในระหว่างการแยกตัว ปรากฏการณ์ของการแตกตัวในจุลินทรีย์ที่ทำให้เกิดโรคนั้นสังเกตได้ภายใต้อิทธิพลของยาปฏิชีวนะและเคมีบำบัดปัจจัยภูมิคุ้มกันเฉพาะที่เกิดขึ้นระหว่างกระบวนการติดเชื้อรวมถึงปัจจัยด้านสิ่งแวดล้อม ในบรรดารูปแบบคร่าวๆของอาณานิคม ได้แก่ พับ, หมุน, ในลักษณะที่คล้ายกับพื้นผิวของสมองที่บิดเบี้ยวด้วยการโน้มน้าวใจ; กระปมกระเปา, ศูนย์กลางหรือเส้นรัศมี; shagreen คือเนื้อละเอียด
สีอาณานิคม กำหนดโดยเม็ดสีที่ผลิตโดยวัฒนธรรมของจุลินทรีย์ แบคทีเรียก่อโรคส่วนใหญ่ไม่ได้สร้างเม็ดสี อันเป็นผลมาจากการที่โคโลนีของพวกมันไม่มีสีหรือมีสีขุ่นคล้ายน้ำนม คล้ายกับโอปอล ในแสงที่ส่องผ่าน อาณานิคมดังกล่าวมีความโปร่งใสไม่มากก็น้อย จุลินทรีย์ที่สร้างเม็ดสีให้อาณานิคมของสีต่างๆ: ครีม, เหลือง, ส้มทอง, น้ำเงิน, แดง, ม่วง, ดำ, ฯลฯ
โครงสร้างอาณานิคม กำหนดในแสงส่องผ่านที่กำลังขยายด้วยกล้องจุลทรรศน์ต่ำ รูรับแสงแคบ หรือด้วยคอนเดนเซอร์ที่ต่ำลงเล็กน้อย ในโคโลนีสีและโคโลนีที่ไม่ส่งแสงจะไม่ถูกกำหนด
โดยธรรมชาติของโครงสร้างอาณานิคมประเภทต่อไปนี้มีความโดดเด่น:
1) ไฮยาลิน - ไม่มีสี โปร่งใส ไม่มีโครงสร้างที่ชัดเจน
2) เม็ดเล็กซึ่งขึ้นอยู่กับขนาดของเมล็ดพืชแบ่งออกเป็นเม็ดละเอียดและเนื้อหยาบ
3) เส้นใยหรือเส้นใยมีลักษณะเป็นเส้นใยยาวพันกันหนาแน่นในความหนาของอาณานิคม
อาณานิคมเป็นเนื้อเดียวกันหรือต่างกัน โครงสร้างของอดีตจะเหมือนกันทุกส่วน ในส่วนหลังส่วนกลางแตกต่างจากส่วนปลาย หรือแต่ละส่วนมีโครงสร้างที่ไม่เหมือนกับมวลส่วนอื่นๆ
ความสม่ำเสมอของอาณานิคม ซึ่งกำหนดสถานะทางกายภาพนั้นตรวจสอบโดยการสัมผัสหรือนำส่วนหนึ่งของวัสดุจากมันด้วยห่วงแบคทีเรีย โดยธรรมชาติของความสม่ำเสมอของอาณานิคมคือ:
1) เป็นแป้งเปียก ลอกออกได้ง่าย และกัดเซาะบนพื้นผิวของสารอาหาร เช่น เนย
2) หนืดหรือเมือกติดและเอื้อมมือ;
3) เส้นใยหรือหนังเหนียวหนาแน่นลบออกจากพื้นผิวของสารอาหารในรูปแบบของฟิล์มยืดหยุ่นที่สอดคล้องกับขนาดและรูปร่างของอาณานิคม
4) ห่วงแห้งและเปราะบางเมื่อสัมผัส
คุณสมบัติของการเจริญเติบโตของจุลินทรีย์บนตัวกลางธาตุอาหารเหลวสำหรับสารอาหารที่เป็นของเหลว ธรรมชาติของการเจริญเติบโตของจุลินทรีย์มีความหลากหลายน้อยกว่าอาหารที่เป็นของแข็ง อย่างไรก็ตาม มีการระบุรูปแบบของการเจริญเติบโตของแบคทีเรียต่อไปนี้ด้วย
1. การเจริญเติบโตของแบคทีเรียที่มีความขุ่นสม่ำเสมอของตัวกลาง ซึ่งสียังคงไม่เปลี่ยนแปลงหรือเปลี่ยนแปลงตามสีของเม็ดสีที่ละลายน้ำได้ซึ่งเกิดขึ้นในวัฒนธรรมของจุลินทรีย์ การเจริญเติบโตดังกล่าวเป็นลักษณะเฉพาะของแบคทีเรียก่อโรคหลายชนิดที่อยู่ในกลุ่มของจุลินทรีย์แบบไม่ใช้ออกซิเจน
2. การเจริญเติบโตของสัตว์หน้าดิน แบคทีเรียมีลักษณะเฉพาะโดยการก่อตัวของตะกอนที่ด้านล่างของหลอดทดลองที่มีสารอาหารที่เป็นของเหลว ตะกอนอาจมีจำนวนน้อยหรือมาก ร่วน เป็นเนื้อเดียวกัน มีเส้นใยหรืออยู่ในรูปแบบของสะเก็ดหลวมขนาดใหญ่ หนืด ลื่นไหล เปราะหรือซีดจางในความสม่ำเสมอ ธาตุอาหารเหนือตะกอนอาจจะใสหรือมีเมฆมาก สีของตะกอนและตัวกลางด้านบนนั้นพิจารณาจากการมีอยู่ของเม็ดสีที่เกิดจากการเพาะเลี้ยงจุลินทรีย์ หากวัฒนธรรมไม่ก่อให้เกิดเม็ดสี สีของตัวกลางจะไม่เปลี่ยนแปลง และตะกอนจะกลายเป็นสีเทาอมเทาหรือ สีเหลือง. การเจริญเติบโตด้านล่างนั้นจำเพาะสำหรับแบคทีเรียที่มีการหายใจแบบไม่ใช้ออกซิเจน
3. การเจริญเติบโตข้างขม่อม แบคทีเรียแสดงออกในความจริงที่ว่าสารอาหารในหลอดทดลองยังคงโปร่งใสอย่างสมบูรณ์ แบคทีเรียเติบโตก่อตัวเป็นสะเก็ดหลวมขนาดใหญ่ไม่มากก็น้อยหรือในทางกลับกันเม็ดเล็ก ๆ ที่ติดอยู่กับพื้นผิวด้านในของผนังหลอดเลือดซึ่งขึ้นอยู่กับชนิดของแบคทีเรียพวกมันจะถูกลบออกได้ง่ายหรือยาก
4. การเจริญเติบโตของพื้นผิว แบคทีเรียมีลักษณะเฉพาะโดยการปรากฏตัวของฟิล์มบนพื้นผิวของสารอาหารที่เป็นของเหลว ลักษณะและลักษณะอาจแตกต่างกัน:
ก) ฟิล์มมีความบาง ละเอียดอ่อน ไม่มีสี มีลักษณะเป็นคราบพลัคที่แทบจะสังเกตไม่เห็นที่หายไปเมื่อเขย่าหลอดและตัวกลางถูกกวน
ข) ฟิล์มมีความชื้น หนา มองเห็นได้ด้วยตาเปล่าชัดเจน มีความหนืด เหนียวข้น ติดที่ห่วงและเหยียดไปทางด้านหลัง
c) ฟิล์มมีความหนาแน่น แห้ง ดูเหมือนชิ้นส่วนของผิวหนัง และเมื่อคุณพยายามนำวัสดุออกจากฟิล์ม ฟิล์มจะถูกลบออกทั้งหมดในรูปแบบของจานกลมที่สอดคล้องกับเส้นผ่านศูนย์กลางของหลอดทดลอง:
d) ฟิล์มมีความหนาแน่น แห้ง มีรอยย่นและบางครั้งก็มีพื้นผิวที่กระปมกระเปาติดกับผนังของเรือด้วยขอบ เมื่อเขย่าของเหลวหรือสัมผัสวงแบคทีเรีย มันจะแตกเป็นชิ้น ๆ ที่จมลงไปในระดับความลึกของของเหลว
สีของฟิล์ม เช่นเดียวกับสื่อการเจริญเติบโต ขึ้นอยู่กับเม็ดสีที่เกิดจากวัฒนธรรมการเติบโตของจุลินทรีย์ การเจริญเติบโตของแบคทีเรียในรูปของฟิล์มพื้นผิวเป็นลักษณะของจุลินทรีย์แอโรฟิลิก
การเจริญเติบโตบนสารอาหารกึ่งของเหลวเพื่อระบุลักษณะของการเจริญเติบโตของจุลินทรีย์บนอาหารกึ่งของเหลว วัฒนธรรมภายใต้การศึกษาจะถูกเพาะในคอลัมน์ของวุ้นกึ่งของเหลว 0.2-0.5% เพื่อให้ลักษณะของการเจริญเติบโตปรากฏอย่างชัดเจนที่สุด การเจาะของสื่อจะทำใกล้กับผนังของหลอดทดลอง การหว่านในลักษณะนี้ทำให้สามารถระบุเผ่าพันธุ์เคลื่อนที่ของจุลินทรีย์และแยกความแตกต่างจากจุลินทรีย์ที่ไม่สามารถเคลื่อนที่ได้
จุลินทรีย์เคลื่อนที่ในคอลัมน์ของวุ้นกึ่งของเหลวทำให้เกิดความขุ่นเด่นชัด โดยจะกระจายไปทั่วความหนาทั้งหมดของตัวกลางมากหรือน้อยเท่าๆ กัน
รูปแบบที่เคลื่อนที่ไม่ได้ของจุลินทรีย์จะเติบโตตามรอยเจาะของตัวกลางเท่านั้น ซึ่งคล้ายกับแท่งน้ำแข็งทรงกระบอกหรือทรงกรวย ในขณะเดียวกัน สิ่งแวดล้อมยังคงโปร่งใสอย่างสมบูรณ์
บทที่ 7 วิธีการศึกษาคุณสมบัติทางชีวเคมีของจุลินทรีย์
วัตถุประสงค์ของบทเรียน เพื่อศึกษาความแตกต่างทางชีวเคมีของจุลินทรีย์
วัสดุและอุปกรณ์ ชุดสารอาหาร ศึกษาวัฒนธรรมของจุลินทรีย์
วิธีการศึกษาคุณสมบัติทางชีวเคมีของจุลชีพ
เอนไซม์มีบทบาทสำคัญในชีวิตของจุลินทรีย์ พวกเขาเป็นผู้มีส่วนร่วมในปฏิกิริยาทางชีวเคมีต่างๆ ที่รองรับการทำงานของโภชนาการ การหายใจ และการสืบพันธุ์ จุลินทรีย์แต่ละชนิดสร้างชุดของเอ็นไซม์คงที่ ซึ่งบางชนิดสามารถย่อยสลายโปรตีนและคาร์โบไฮเดรตได้ในระดับต่างๆ ในขณะที่บางชนิดทำให้เกิดปฏิกิริยาออกซิเดชันและการลดลงของสารตั้งต้นต่างๆ ความเสถียรของระบบเอนไซม์ของแบคทีเรียทำให้สามารถใช้คุณสมบัติทางชีวเคมีของแบคทีเรียร่วมกับลักษณะทางสัณฐานวิทยา วัฒนธรรม และลักษณะคงที่อื่นๆ เพื่อระบุชนิดและชนิดของแบคทีเรียได้ ในการตรวจหาเอ็นไซม์ การเพาะเลี้ยงจุลินทรีย์ภายใต้การศึกษาจึงถูกเพาะบนสื่อสารอาหารเพื่อการวินิจฉัยแยกโรคแบบพิเศษ
คุณสมบัติ Saccharolytic ของจุลินทรีย์ ความสามารถในการย่อยสลายคาร์โบไฮเดรตและแอลกอฮอล์ที่มีอะตอมสูง ซึ่งมักจะรวมกันเป็นกลุ่มเดียวที่เรียกว่าน้ำตาล มีอยู่ในจุลินทรีย์หลายชนิด ภายใต้การกระทำของเอนไซม์ saccharolytic ของแบคทีเรีย น้ำตาลจะถูกย่อยสลายเป็นอัลดีไฮด์และกรด ผลิตภัณฑ์ขั้นสุดท้ายของการแยกสารคือสารที่เป็นก๊าซ: CO2 และ H2 เป็นลักษณะเฉพาะที่ ประเภทต่างๆและแม้แต่จุลินทรีย์หลายชนิดก็ใช้น้ำตาลชนิดเดียวกันต่างกัน ตัวอย่างเช่น แบคทีเรียบางชนิดที่หมักแลคโตส ยังคงเป็นกลางเมื่อเทียบกับกลูโคส แบคทีเรียอื่นๆ ตรงกันข้าม หมักกลูโคส และตัวที่สาม แอคทีฟมากที่สุด ทำให้เกิดการสลายตัวของทั้งกลูโคสและแลคโตส ในการตรวจหาเอนไซม์แซคคาโรไลติก วัฒนธรรมที่ศึกษาของแบคทีเรียจะถูกฉีดวัคซีนลงในอาหารเลี้ยงเชื้อ Hiss หรือที่เรียกว่าแถว "ที่แตกต่างกัน" แถว "Motley" Hiss แบบสั้นมักประกอบด้วยหลอดทดลอง 5 หลอด ได้แก่ กลูโคส แลคโตส แมนนิทอล มอลโตส และซูโครส ในการศึกษาบางชิ้น เพื่อศึกษาคุณสมบัติทางชีวเคมีของจุลินทรีย์ที่แยกได้ในเชิงลึก ชุด Hiss ได้รับการเสริมด้วย dulcitol, sorbitol, xylose, arabinose และน้ำตาลอื่นๆ ชื่อชุด "แตกต่าง" เกิดจากความจริงที่ว่าภายใต้การกระทำของเอนไซม์จุลินทรีย์คาร์โบไฮเดรตบางชนิดยังคงไม่เปลี่ยนแปลงดังนั้นสีของสารอาหารจึงไม่เปลี่ยนแปลงในขณะที่น้ำตาลอื่น ๆ สลายตัวทำให้เกิดผลิตภัณฑ์สลายตัวที่เป็นกรดที่เปลี่ยนไป สีของตัวบ่งชี้และดังนั้นสีของสารอาหาร สารฟ่อเป็นของเหลวและกึ่งของเหลว (โดยเติมวุ้นวุ้น 0.2-0.5%) ในหลอดทดลองที่มีสื่อของเหลวของ Giss เพื่อตรวจจับก๊าซซึ่งเป็นผลิตภัณฑ์สุดท้ายของการสลายตัวของน้ำตาล "ลอย" จะลดลง - หลอดที่มีเส้นผ่านศูนย์กลาง 0.5-0.7 ซม. ปิดผนึกที่ปลายด้านหนึ่ง "โฟลต" ถูกวางโดยปลายบัดกรี ในระหว่างการฆ่าเชื้อจะเต็มไปด้วยสารอาหาร เมื่อผลิตภัณฑ์ที่เป็นก๊าซก่อตัวขึ้นในตัวกลาง พวกมันจะแทนที่ส่วนหนึ่งของของเหลวใน "ลอย" ซึ่งเป็นผลมาจากการที่ฟองอากาศรวมตัวกันที่ปลายปิดผนึก ในตัวกลาง Hiss กึ่งของเหลว การก่อตัวของก๊าซจะถูกกำหนดโดยการมีอยู่ของฟองก๊าซขนาดเล็กในความหนาของตัวกลางและโฟมที่คงอยู่บนพื้นผิวของมัน ดังนั้นเมื่อศึกษาเอ็นไซม์ saccharolytic ที่หลั่งโดยจุลินทรีย์ เราไม่เพียงคำนึงถึงปรากฏการณ์ของการสลายน้ำตาลบางชนิดโดยการเกิดกรดเท่านั้น แต่ยังคำนึงถึงความลึกของกระบวนการของเอนไซม์ด้วยการปรากฏตัวของผลิตภัณฑ์ที่เป็นก๊าซในอาหาร หลอดทดลองพร้อมชุดสื่อ Hiss วางในชั้นวางในแถวเดียว หลอดทดลองแต่ละหลอดจะมีชื่อน้ำตาลที่บรรจุอยู่ในสื่อ ในหลอดทดลองแรกของแต่ละแถว นอกจากชื่อน้ำตาลแล้ว ให้ระบุจำนวนหรือประเภทของการเพาะเชื้อจุลินทรีย์ที่กำลังศึกษา นำวัฒนธรรมที่ปลายห่วงในปริมาณเล็กน้อยและหว่านตามวิธีที่ยอมรับโดยทั่วไป
คุณสมบัติสลายโปรตีนของจุลินทรีย์ จุลินทรีย์บางชนิดผลิตและหลั่งเอนไซม์สลายโปรตีนในสภาพแวดล้อมภายนอก - โปรตีเอสที่เร่งการสลายตัวของโปรตีน อันเป็นผลมาจากการแยกตัวของโมเลกุลโปรตีนทำให้เกิดผลิตภัณฑ์จากการย่อยสลายระดับโมเลกุลสูง - เปปโทน, อัลบูโมสและโพลีเปปไทด์ ภายใต้การกระทำของเอนไซม์โปรตีโอไลติกอื่น ๆ ในทางกลับกันเปปโทนจะถูกแยกออกเป็นโพลีเปปไทด์ (สารประกอบของกรดอะมิโนสองชนิดขึ้นไป) และกรดอะมิโนแต่ละตัว เพื่อระบุเอนไซม์โปรตีโอไลติก การเพาะเลี้ยงจุลินทรีย์ภายใต้การศึกษาจะถูกฉีดวัคซีนเข้าไปในอาหารที่มีโปรตีนอย่างน้อยหนึ่งชนิด ส่วนใหญ่มักใช้เจลาตินเพื่อจุดประสงค์นี้ไม่บ่อยนัก - หางนมข้น, ไข่ขาวที่จับเป็นก้อน, นมหรือเนื้อต้ม กิจกรรมการสลายโปรตีนของจุลินทรีย์ชนิดเดียวกัน เมื่อพิจารณาจากสารอาหารที่แตกต่างกัน จะแสดงออกมาแตกต่างกัน เนื่องจากความจำเพาะของเอนไซม์ ดังนั้นสำหรับจุลินทรีย์ประเภทต่างๆ แนะนำให้ใช้สารอาหารที่มีองค์ประกอบต่างกัน
การกำหนดกิจกรรมการย่อยโปรตีนของจุลินทรีย์
ก) เจลาติน เจลาตินเปปโตนเนื้อเทลงในหลอดทดลองในคอลัมน์ 5-6 มล. การหว่านทำได้โดยการฉีด จุ่มลูปกับวัฒนธรรมภายใต้การศึกษาลึกเข้าไปในอาหารเลี้ยงเชื้อจนถึงก้นหลอด จุลินทรีย์ที่สามารถเติบโตได้ที่อุณหภูมิต่ำจะถูกทิ้งไว้ในห้องที่อุณหภูมิ 20-22°C พืชที่เหลือจะถูกฟักในเครื่องควบคุมอุณหภูมิที่ 37 °C เมื่อรวมกับหลอดทดลองทดลองแล้ว หลอดทดลองหนึ่งหรือสองหลอดที่มีเจลาตินที่ไม่ได้ใส่เชื้อจะถูกวางในเทอร์โมสตัทเพื่อควบคุม ที่อุณหภูมิ 37 ° C เจลาตินจะละลาย ดังนั้นหลังจากฟักตัวแล้ว หลอดทดลองที่ถอดออกจากเทอร์โมสตัทจะถูกลดระดับลงในน้ำเย็นหรือใส่ในตู้เย็น หลังจากเจลาตินเจลาติไนเซชันในหลอดทดลองควบคุม พวกเขาเริ่มมองเห็นการเจริญเติบโตและคำนึงถึงการเปลี่ยนแปลงในตัวกลางธาตุอาหารของหลอดทดลอง โดยที่ภายใต้การกระทำของเอนไซม์เจลาติเนส โปรตีนเจลาตินถูกย่อยสลาย สารอาหารจะถูกทำให้เป็นของเหลว หลอดทดลองที่ตัวกลางยังคงไม่เปลี่ยนแปลงหลังจากการฟักตัวทุกวันทิ้งไว้ในเทอร์โมสตัท การเปลี่ยนแปลงในตัวกลางจะได้รับการตรวจสอบเป็นเวลา 20 วัน ในโปรโตคอลของการศึกษาจะต้องสังเกตวันที่ปรากฏสัญญาณของการทำให้เป็นของเหลวของตัวกลางระดับและลักษณะของการทำให้เป็นของเหลว
b) บนวุ้นนมไอค์มัน วุ้นนมของ Eikman ที่เทและแช่เย็นในจานเพาะเชื้อ ได้รับการเพาะเลี้ยงด้วยเชื้อจุลินทรีย์ที่ศึกษา การหว่านทำได้โดยใช้ห่วงหรือไม้พายเพื่อให้ได้อาณานิคมที่แยกได้ หลังจากการฟักไข่ในเทอร์โมสตัท 24-48 ชั่วโมง วัฒนธรรมที่ผลิตเอนไซม์โปรตีโอไลติกจะทำให้เกิดเปปโทไนเซชันของโปรตีนนม - เคซีน ซึ่งเป็นผลมาจากการสร้างโซนโปร่งใสรอบ ๆ อาณานิคมดังกล่าว ซึ่งโดดเด่นอย่างชัดเจนเมื่อเทียบกับพื้นหลังที่มีเมฆมากโดยทั่วไปของ ปานกลาง.
c) บนซีรั่มเลือดจับตัวเป็นลิ่ม วัฒนธรรมของจุลินทรีย์แอโรบิกที่ศึกษาได้รับการฉีดวัคซีนบนถ้วย ซึ่งเป็นจุลินทรีย์แบบไม่ใช้ออกซิเจน โดยฉีดเข้าไปในคอลัมน์ของซีรั่มม้าที่จับตัวเป็นก้อน บ่มในเทอร์โมสตัทที่อุณหภูมิ 37 °C สายพันธุ์ที่ผลิตเอนไซม์โปรตีโอไลติก เจือจางสารอาหาร ก่อให้เกิดการกดทับรอบๆ โคโลนีหรือบนพื้นผิวของคอลัมน์สื่อ
ง) ในน้ำซุปไก่ ไข่ขาว. ในหลอดทดลองที่มีน้ำซุปเนื้อเปปโทนหรือน้ำซุปของ Hottinger ที่มีโปรตีนไก่ที่พับไว้ จะมีการเพิ่มการเพาะเชื้อจุลินทรีย์หนึ่งวงภายใต้การศึกษา มีการดูพืชผลทุกวันเป็นเวลา 5 วัน การเพาะเลี้ยงจุลินทรีย์ที่ใช้งานโปรตีโอไลติกจะทำลายไข่ขาวที่จับตัวเป็นก้อน ชิ้นส่วนของโปรตีนที่บรรจุอยู่ในสื่อจะลดขนาดลงอย่างเห็นได้ชัด กลายเป็นมวลร่วนหรือละลายจนหมด ในทำนองเดียวกัน คุณสมบัติการย่อยโปรตีนของจุลินทรีย์จะปรากฏในสื่อที่มีเนื้อต้มชิ้นหนึ่ง
จุลินทรีย์ที่ทำให้เกิดโรคบางชนิดที่มีกิจกรรมการสลายโปรตีนที่เด่นชัดมีความสามารถในการทำลายโปรตีนและเปปโตนให้เป็นผลิตภัณฑ์ที่มีการสลายตัวลึก: อินโดล ไฮโดรเจนซัลไฟด์ ยูเรีย และแอมโมเนีย ในการพิจารณาประเภทและความแตกต่างของจุลินทรีย์ที่ทำให้เกิดโรค การระบุผลิตภัณฑ์สองรายการแรก: อินโดลและไฮโดรเจนซัลไฟด์มีความสำคัญมากที่สุด
การกำหนดอินโดลในการเพาะเชื้อจุลินทรีย์ อินโดลเกิดจากการสลายของกรดเฮเทอโรไซคลิกที่ซับซ้อน - ทริปโตเฟน ในการตรวจจับการก่อตัวของอินโดล วงจรของวัฒนธรรมภายใต้การศึกษาจะถูกฉีดวัคซีนลงในอาหารเลี้ยงเชื้อของ Strogoff หรือสื่ออื่นๆ ที่แนะนำสำหรับการตรวจจับอินโดล ทันทีหลังจากฉีดวัคซีน แถบกระดาษตัวบ่งชี้ที่ชุบด้วยสารละลายของกรดออกซาลิกจะถูกนำเข้าไปในหลอดทดลองเพื่อไม่ให้กระดาษตัวบ่งชี้สัมผัสกับสารอาหาร เมื่อต้องการทำเช่นนี้ แถบกระดาษที่สามบนถูกกดด้วยไม้ก๊อกที่ผนังของหลอดทดลอง พืชผลจะถูกฟักเป็นเวลา 24-48 ชั่วโมงที่อุณหภูมิ 37°C การก่อตัวของอินโดลถูกกำหนดโดยสีของปลายล่างของกระดาษตัวบ่งชี้เป็นสีชมพูอ่อน ซึ่งมองเห็นได้ชัดเจนในแสงที่ส่องผ่าน
คำจำกัดความของไฮโดรเจนซัลไฟด์ ไฮโดรเจนซัลไฟด์เป็นผลพลอยได้จากการสลายกรดอะมิโน ได้แก่ ซีสทีน ซีสเตอีน และเมไทโอนีนที่มีกำมะถัน วงจรของการเพาะเชื้อจุลินทรีย์ที่ศึกษาจะถูกฉีดวัคซีนลงในหลอดทดลองด้วยน้ำซุปเนื้อเปปโตนหรือน้ำซุป Hottinger ทันทีหลังจากฉีดวัคซีน แถบกระดาษตัวบ่งชี้ที่ชุบด้วยตะกั่วอะซิเตทจะถูกเติมลงในหลอดทดสอบเพื่อตรวจวัดไฮโดรเจนซัลไฟด์ ในกรณีที่เป็นบวก ไฮโดรเจนซัลไฟด์ที่เกิดขึ้นในวัฒนธรรมจะรวมกับตะกั่วอะซิเตทที่ไม่มีสีและกลายเป็นตะกั่วซัลเฟต ซึ่งทำให้กระดาษตัวบ่งชี้มีสีน้ำตาลดำ
การบัญชีขั้นสุดท้ายของผลลัพธ์สำหรับการก่อตัวของอินโดลและไฮโดรเจนซัลไฟด์จะดำเนินการในวันที่ 7-10 หลังจากการหว่านเมล็ดเนื่องจากกระบวนการแตกแยกของเอนไซม์ของโปรตีนและการก่อตัวของผลิตภัณฑ์สุดท้ายของการสลายตัวบางครั้งเกิดขึ้นเป็นเวลานาน
คุณสมบัติรีดอกซ์ของจุลินทรีย์ เอนไซม์รีดอกซ์ที่เกี่ยวข้องกับการทำงานของระบบทางเดินหายใจของจุลินทรีย์ส่วนใหญ่สามารถพบได้ในการเพาะเลี้ยงเชื้อจุลินทรีย์ ดังที่ทราบกระบวนการของการเกิดออกซิเดชันของสารตั้งต้นสามารถเกิดขึ้นได้โดยการแนบออกซิเจนเข้ากับเอนไซม์ออกซิเดสหรือโดยการขจัดไฮโดรเจนออกจากมันด้วยการมีส่วนร่วมของเอนไซม์ดีไฮเดรส ปฏิกิริยาประเภทนี้มีลักษณะเฉพาะจากข้อเท็จจริงที่ว่าการเกิดออกซิเดชันของสารหนึ่งจะมาพร้อมกับการลด (รีดักชัน) ของสารอินทรีย์อื่นเสมอ สารแรกที่แยกไฮโดรเจนออกเรียกว่าผู้ให้และสารที่ติดอยู่เรียกว่าตัวรับ ตัวรับไฮโดรเจนส่วนใหญ่มักจะเป็นออกซิเจนในอากาศ แต่ก็สามารถเป็นสารประกอบอินทรีย์หลายชนิดที่สามารถออกซิไดซ์และลดลงได้ง่าย เพื่อที่จะระบุเอ็นไซม์ดีไฮเดรสและกำหนดกิจกรรมของพวกมันในการปฏิบัติของการวิจัยทางจุลชีววิทยา ได้มีการเสนอวิธีการบนพื้นฐานของการนำสีย้อมอินทรีย์เข้าไปในอาหารซึ่งทำหน้าที่เป็นตัวรับไฮโดรเจน เป็นผลมาจากการเติมไฮโดรเจน สีย้อมจะลดลง กลายเป็นสารประกอบไม่มีสีที่เรียกว่าลิวโคเบส ด้วยการเข้าถึงออกซิเจนอย่างมากมาย มันสามารถออกซิไดซ์อีกครั้งและได้สีเดิม เมทิลีนบลู, สารลิตมัสทิงเจอร์, มาลาไคต์กรีน, อินดิโก้คาร์มีน, สีแดงเป็นกลาง, ฯลฯ ถูกใช้เป็นตัวรับไฮโดรเจนเพื่อเผยให้เห็นคุณสมบัติการลดของจุลินทรีย์สีย้อมเหล่านี้จะถูกเพิ่มลงในสื่อสารอาหารตามปกติ: น้ำซุปเนื้อเปปโตนเนื้อเปปโตน วุ้น, นม. จุลินทรีย์ชนิดเดียวกันมีพฤติกรรมแตกต่างกันไปตามสีที่มีองค์ประกอบต่างกัน คุณสมบัติของจุลินทรีย์นี้ใช้ในทางปฏิบัติทางจุลชีววิทยาเป็นคุณลักษณะที่แตกต่างกัน แบคทีเรียไทฟอยด์ลดเมทิลีนบลูแต่ไม่ลดสารสีน้ำเงินและไม่เปลี่ยนสีแดงที่เป็นกลาง ตรงกันข้ามกับอีโคไลซึ่งยังคงเป็นกลางสำหรับเมทิลีนบลู แต่จะลดสารสีน้ำเงินและสีแดงที่เป็นกลาง
การกำหนดความสามารถในการลด
1. ในนมขนาดกลาง 5 มล. ที่มีเมทิลีนบลู - เพาะเลี้ยงวงจรของวัฒนธรรมที่ศึกษาจากอาหารที่มีความหนาแน่นสูงหรือ 0.1 มล. ของวัฒนธรรมน้ำซุป 18 ชั่วโมงและหลังจากฟักตัวหนึ่งชั่วโมงผลการเจริญเติบโตจะถูกนำมาพิจารณา . ด้วยปฏิกิริยาเชิงบวกต่อการลดลงของเมทิลีนบลู สื่อจะเปลี่ยนจากสีน้ำเงินเป็นสีครีม และด้วยปฏิกิริยาเชิงบวกเล็กน้อย สื่อดังกล่าวจะได้สีเขียว
2. หลอดทดลองที่มีนมลิตมัส อาหารของ Minkevich ได้รับการฉีดวัคซีนในลักษณะเดียวกับนมที่มีเมทิลีนบลู ซึ่งเป็นวัฒนธรรมประจำวันจากอาหารที่เป็นของแข็งหรือของเหลว พืชผลจะถูกฟักด้วยเทอร์โมสตัทเป็นเวลา 10 วัน โดยสังเกตการเปลี่ยนสีของอาหารทุกวัน การลดลงของสารสีน้ำเงินนั้นเกิดจากการเปลี่ยนสีของนมอย่างสมบูรณ์ซึ่งมีสีม่วงอมชมพูก่อนหว่าน ในโปรโตคอลการศึกษา การลดลงของสารสีน้ำเงินแสดงด้วยตัวอักษร P
สื่อของ Minkevich ยังทำให้สามารถตรวจจับการก่อตัวของกรดหรือด่างซึ่งแสดงออกตามลำดับในสีแดงหรือสีน้ำเงินของสภาพแวดล้อมของนม การก่อตัวของกรดแสดงด้วยตัวอักษร K, ด่าง - โดยตัวอักษร W.
ความมุ่งมั่นของเอนไซม์คาตาเลส จุลินทรีย์บางชนิดที่อยู่ในกลุ่มแอโรบิกในกระบวนการหายใจจะก่อตัวเป็นไฮโดรเจนเปอร์ออกไซด์ซึ่งเป็นพิษต่อเซลล์ ปริมาณไฮโดรเจนเปอร์ออกไซด์ในวัฒนธรรมไม่เคยมีความเข้มข้นสูง เนื่องจากเมื่อก่อตัวขึ้น เปอร์ออกไซด์จะถูกย่อยสลายเป็นน้ำและออกซิเจนระดับโมเลกุลด้วยการมีส่วนร่วมของเอนไซม์คาตาเลส บนพื้นผิวของการเพาะเลี้ยงจุลินทรีย์ที่ปลูกบนอาหารที่มีสารอาหารหนาแน่นในจานเพาะเชื้อ ใช้สารละลายไฮโดรเจนเปอร์ออกไซด์ 1% 1-2 มล. เพื่อให้ครอบคลุมพื้นผิวของวัฒนธรรมด้วยชั้นบาง ๆ การปรากฏตัวของฟองก๊าซในชั้นของของเหลวที่ใช้บ่งบอกถึงการก่อตัวของออกซิเจนอันเป็นผลมาจากการแยกไฮโดรเจนเปอร์ออกไซด์ภายใต้การกระทำของคาตาเลส ผลลัพธ์ที่คล้ายคลึงกันในโปรโตคอลของการทดลองถูกทำเครื่องหมายด้วยเครื่องหมาย + ซึ่งเป็นผลบวกของปฏิกิริยาต่อ catalase
บทที่ 8 วิธีการวิจัยทางจุลชีววิทยาของน้ำ อากาศ และดิน
เป้าบทเรียนทำความคุ้นเคยกับกฎการรับและส่งตัวอย่างน้ำและดินเพื่อการวิจัย กำหนดจำนวนจุลินทรีย์ที่มีชีวิตทั้งหมดใน 1 กรัมหรือ 1 มล. สำรวจอากาศโดยการตกตะกอน (วิธีของโคช)
อุปกรณ์และวัสดุขวดปลอดเชื้อพร้อมจุกปิด หลอดทดลองที่มีน้ำปราศจากเชื้อ 9 มล. ในแต่ละจานเลี้ยงเชื้อที่ห่อด้วยกระดาษ ปิเปตปลอดเชื้อ (อันละ 2 มล.) หลอดที่มี MPA หลอมเหลว หลอดละ 12 มล. ลูปจุลินทรีย์ สไลด์และใบปะหน้า สารละลายลูกอล น้ำมันซีดาร์. หัวเตา.
การเพาะเลี้ยงแบคทีเรียชนิดต่างๆ เป็นหนึ่งในวิธีการที่มีประสิทธิภาพและใช้กันอย่างแพร่หลาย ซึ่งปัจจุบันมีการใช้อย่างแข็งขันในด้านจุลชีววิทยาทางการแพทย์ นอกจากนี้ วิธีนี้ยังขาดไม่ได้ในด้านเทคโนโลยีชีวภาพ ซึ่งมีบทบาทสำคัญในการศึกษาคุณสมบัติต่างๆ ของธรรมชาติทั้งทางชีววิทยาและชีวเคมี วิธีนี้หมายถึงกระบวนการเพาะเลี้ยงสิ่งมีชีวิตด้วยกล้องจุลทรรศน์โดยใช้ลักษณะและคุณสมบัติต่างกัน
วัฒนธรรมทางแบคทีเรียสามารถดำเนินการได้เพื่อวัตถุประสงค์ในการตรวจอย่างละเอียดของเซลล์ที่แยกจากกันของดวงตา อวัยวะสืบพันธุ์ของมนุษย์ ตลอดจนเพื่อการวิเคราะห์เลือด ปัสสาวะ หรืออุจจาระที่แม่นยำที่สุด เพาะเชื้อแบคทีเรียในน้ำอสุจิและเสมหะเพื่อการวิจัย มักจะมีขั้นตอนการหว่าน
สภาพแวดล้อมในการเลี้ยงแบคทีเรียคืออะไร
เมื่อเลือกสื่อสำหรับการเพาะ อันดับแรกควรเน้นที่ธรรมชาติของเนื้อหาที่มีอยู่ในแบคทีเรียซึ่งเป็นเป้าหมายหลักของการศึกษา ในกรณีที่จำเป็นต้องได้รับการแยกออกมารวมทั้งกำหนดวัฒนธรรมที่บริสุทธิ์ ควรทำการฉีดวัคซีนบนอาหารที่มีสารอาหารหนาแน่น
แต่ถ้าวัสดุที่จะตรวจสอบไม่มีจุลินทรีย์จำนวนมากสามารถใช้สารอาหารที่เป็นของเหลวเพื่อการนี้ได้
มีสารอาหารหลายประเภทที่เพาะเลี้ยงแบคทีเรีย ดังนั้นจึงเป็นเรื่องปกติที่จะแยกแยะระหว่างสภาพแวดล้อมแบบธรรมดาและแบบพิเศษ ตลอดจนการวินิจฉัยแบบเลือกและแบบแยกส่วน สื่อแต่ละประเภทมีของตัวเอง ลักษณะเฉพาะตัวและลักษณะ
ผู้ป่วยกำหนดให้ตรวจปัสสาวะด้วยการเพาะเชื้อแบคทีเรียในกรณีใดบ้าง?
การวิเคราะห์ด้วยการเพาะเชื้อแบคทีเรียในปัสสาวะมีความเกี่ยวข้องในหลายกรณี:
- ในที่ที่มีโรคติดเชื้อของระบบทางเดินปัสสาวะ
- ด้วยโรคเบาหวาน
- ระหว่างตั้งครรภ์
- เพื่อชี้แจงการวินิจฉัยหากโรคผิดปกติ
การวิเคราะห์ประเภทนี้ต้องใช้ปัสสาวะของผู้ป่วยในตอนเช้า ซึ่งเป็นปริมาณโดยประมาณตั้งแต่สามถึงห้ามิลลิลิตร ก่อนเก็บปัสสาวะเพื่อวิเคราะห์ ผู้ป่วยจำเป็นต้องปฏิบัติตามขั้นตอนสุขอนามัยที่เหมาะสม แต่ไม่สามารถใช้ผลิตภัณฑ์ที่มีคุณสมบัติในการฆ่าเชื้อได้ การส่งปัสสาวะที่เก็บรวบรวมเพื่อการวิเคราะห์จะต้องดำเนินการโดยเร็วที่สุด ด้วยเหตุนี้จึงใช้ภาชนะที่ใช้แล้วทิ้งที่ผ่านการฆ่าเชื้อแล้วซึ่งรับประกันการขนส่งที่ถูกต้องและผลลัพธ์ที่แม่นยำที่สุด



