ที่เป็นเวลาหลายศตวรรษ การมีอยู่ของก๊าซ สารที่มองไม่เห็นเหล่านี้ ได้หลบเลี่ยงความสนใจของผู้คน ความเชื่อมั่นเพิ่มขึ้นทีละน้อยและด้วยความยากลำบากเท่านั้นที่เสริมความแข็งแกร่งว่าก๊าซเป็นวัสดุเช่นเดียวกับทุกสิ่งที่มองเห็นและสัมผัสได้และโดยปราศจากความรู้เกี่ยวกับก๊าซโดยไม่คำนึงถึงการมีส่วนร่วมในปรากฏการณ์ต่าง ๆ มันเป็นไปไม่ได้ที่จะเข้าใจชีวิตทางเคมีของ โลก.
ก๊าซไฮโดรเจนถูกค้นพบโดย T. Paracelsus ในศตวรรษที่ 16 เมื่อเขาแช่เหล็กในกรดซัลฟิวริก แต่ถึงอย่างนั้นก็ไม่มีก๊าซอะไร
หนึ่งในข้อดีที่สำคัญที่สุดของนักเคมีแห่งศตวรรษที่ XVII
ฉันจะ. van Helmont ก่อนที่วิทยาศาสตร์จะโกหกในข้อเท็จจริงที่ว่าเขาเป็นผู้เพิ่มพูนคำศัพท์ของมนุษย์ด้วยคำใหม่ - "แก๊ส" ซึ่งตั้งชื่อสารที่มองไม่เห็นว่า "ซึ่งไม่สามารถเก็บไว้ในภาชนะหรือเปลี่ยนเป็นร่างกายที่มองเห็นได้"
แต่ในไม่ช้านักฟิสิกส์ R. Boyle ก็ค้นพบวิธีรวบรวมและเก็บก๊าซในภาชนะ นี่เป็นก้าวที่สำคัญมากในความรู้เกี่ยวกับก๊าซ และประสบการณ์ของบอยล์สมควรได้รับ คำอธิบายโดยละเอียด. เขาพลิกขวดที่บรรจุกรดซัลฟิวริกเจือจางและตะปูเหล็กคว่ำลงในถ้วยกรดซัลฟิวริก
นี่คือวิธีที่ Boyle อธิบายข้อสังเกตของเขา: “ในทันที ฉันเห็นฟองอากาศเพิ่มขึ้น ซึ่งเชื่อมต่อกัน ทำให้ระดับน้ำลดลงและเข้ามาแทนที่ ในไม่ช้าน้ำทั้งหมดก็ถูกผลักออกจากภาชนะด้านบนและแทนที่ด้วยร่างกายที่มีลักษณะเหมือนอากาศ แต่ที่นี่บอยล์ทำผิดพลาดอย่างร้ายแรง แทนที่จะตรวจสอบธรรมชาติของก๊าซที่เกิดขึ้น เขาระบุก๊าซนี้กับอากาศ
อย่างไรก็ตาม การแก้ไขข้อผิดพลาดของ Boyle นั้นใช้เวลาไม่นาน คุณสมบัติอันน่าทึ่งของก๊าซ ซึ่งบอยล์เก็บรวบรวมครั้งแรกและสับสนกับอากาศจนไม่อาจยอมรับได้ ถูกค้นพบโดยเอ็น. เลเมอรี ผู้ร่วมสมัยของบอยล์ นี่คือวิธีที่เขาบรรยายประสบการณ์ที่ยอดเยี่ยมของเขา: “เมื่อน้ำมันกรดกำมะถัน (กรดซัลฟิวริก) สามออนซ์ * ถูกใส่ในขวดขนาดกลางที่มีน้ำ 12 ออนซ์และตะไบเหล็กหนึ่งออนซ์ถูกโยนทิ้ง การเดือดและการละลายของเหล็กเริ่มต้นขึ้น ซึ่งผลิตไอระเหยไร้สีขึ้นมาที่ด้านบนของภาชนะ เมื่อนำเสี้ยนจุดไฟมาที่คอของภาชนะ ไอน้ำจะถูกดูดกลืนเข้าไปในเปลวไฟทันทีและได้ยินเสียงระเบิดอย่างรุนแรง แล้วไฟก็ดับ อย่างไรก็ตาม หากเรายังคงทิ้งขี้เลื่อยเหล็กต่อไป ภาชนะก็จะเต็มไปด้วยเปลวไฟตลอดเวลา ซึ่งจะทะลุทะลวงและหมุนเวียนไปที่ด้านล่างของภาชนะและเผาไหม้เหมือนคบไฟเหนือคอของมัน
“สำหรับฉัน ดูเหมือนว่า” เลเมรีตกใจ “ว่าแสงวาบเหล่านี้เป็นตัวแทนของวัตถุที่ติดไฟได้ขนาดเล็กที่ไหลและจุดไฟในเมฆ ทำให้เกิดฟ้าร้องและฟ้าผ่า”
"อากาศที่ติดไฟได้" - จากนี้ไปชื่อนี้จะได้รับการแก้ไขเป็นเวลานานสำหรับก๊าซมหัศจรรย์ที่ปล่อยออกมาจากเหล็กจากกรดซัลฟิวริก เป็นเวลานาน แต่ไม่ตลอดไปเพราะชื่อนี้ไม่ถูกต้องหรือไม่ถูกต้อง: ติดไฟได้และก๊าซอื่น ๆ แต่ถ้าเป็นเวลานานนักวิจัยจะสร้างความสับสนให้ก๊าซ "กรดซัลฟิวริกและเหล็ก" กับก๊าซที่ติดไฟได้อื่น ๆ ก็จะไม่มีใครสับสนเช่น Boyle กับอากาศธรรมดา
G. คาเวนดิช
|
มีชายคนหนึ่งที่รับหน้าที่เปิดเผยความลับของที่มาของก๊าซนี้ เขาไม่ได้เป็นสมาชิกของนักเคมีมืออาชีพจำนวนหนึ่ง เช่นเดียวกับที่นักวิจัยหลายคนในสมัยของเขาไม่มี ผู้ซึ่งยังคงยกย่องตัวเองด้วยการค้นพบทางเคมีครั้งยิ่งใหญ่ ต้นกำเนิดอันสูงส่งทำให้เขามีอาชีพที่ยอดเยี่ยมในฐานะรัฐบุรุษ และความมั่งคั่งที่สืบทอดมาโดยไม่ได้ตั้งใจเปิดโอกาสทั้งหมดให้กับชีวิตที่ไร้กังวล แต่ลอร์ดจี. คาเวนดิชละเลยทั้งสองเพราะเห็นแก่ความพึงพอใจที่เจาะลึกความลับของธรรมชาตินำมา ไม่มีแม้แต่รูปเหมือนของปราชญ์ฤาษีผู้นี้เลยแม้แต่น้อย ยกเว้นภาพล้อเลียนที่ไม่ค่อยชำนาญซึ่งไม่เต็มใจอ้างถึงซึ่งถูกอ้างถึงโดยไม่ได้ตั้งใจทุกที่ แต่บันทึกความทรงจำของคนรุ่นเดียวกันของเขาได้รับการเก็บรักษาไว้ซึ่งแทนที่ภาพเหมือนที่เก่งที่สุดได้อย่างสมบูรณ์แบบ อย่างน้อยจากมุมมองของลักษณะทางจิตวิทยาของบุคลิกภาพที่โดดเด่นนี้ นี่เป็นหนึ่งในเรื่องราวเหล่านี้: “เมื่อคาเวนดิชได้รับการแนะนำให้รู้จักกับขุนนางออสเตรียคนหนึ่งซึ่งตามธรรมเนียมของคนสุภาพเริ่มมั่นใจว่าเหตุผลหลักที่เขามาถึงลอนดอนนั้นเป็นความหวังอย่างแม่นยำที่จะได้รู้จักกับหนึ่งในนั้น การตกแต่งที่ยิ่งใหญ่ที่สุดในศตวรรษของเขา - นักธรรมชาติวิทยาสมัยใหม่ที่ยิ่งใหญ่ที่สุด คาเวนดิชไม่ตอบคำพูดโอ้อวดนี้ เขายืนขึ้นด้วยสายตาที่ตกต่ำ สับสนและอับอาย ทันใดนั้นเขาสังเกตเห็นช่องว่างในวงแหวนรอบ ๆ ของผู้คนและด้วยความรวดเร็วทั้งหมดที่เขาสามารถทำได้ รีบวิ่งไปและไม่สงบลงจนกว่าเขาจะรู้สึกปลอดภัยในรถม้าซึ่งเขากลับบ้าน
และชายผู้นี้ที่ปลุกเร้าเพียงความงงงวย เสียงหัวเราะ และความเสียใจที่น่ารังเกียจในสังคม ถูกเปลี่ยนแปลงอย่างสมบูรณ์ในห้องทดลองของเขา: เขาแสดงให้เห็นถึงความเฉลียวฉลาดและความเฉลียวฉลาดที่ไม่ธรรมดาในการทดลอง ความอดทน และความอดทนในการบรรลุเป้าหมาย - พูดได้คำเดียว คุณสมบัติทั้งหมดเหล่านั้นที่ เขาขาดการติดต่อสื่อสารกับผู้คน
ความสุภาพเรียบร้อยของคาเวนดิชนั้นยอดเยี่ยมมากจนเปลี่ยนจากคุณธรรมเป็นรอง เขาตัดสินใจเผยแพร่ผลงานที่เป็นแบบอย่างของเขาด้วยความลังเลและยาวนาน และงานบางชิ้นก็ไม่เห็นแสงสว่างของวันจนกว่าเขาจะเสียชีวิต
ผลงานตีพิมพ์ครั้งแรกของคาเวนดิชในปี พ.ศ. 2309 อุทิศให้กับ "อากาศที่ติดไฟได้" ประการแรก จะเพิ่มจำนวนวิธีในการรับ "อากาศที่ติดไฟได้" ปรากฎว่าก๊าซนี้ได้รับความสำเร็จเท่าเทียมกันหากเหล็กถูกแทนที่ด้วยสังกะสีหรือดีบุกและกรดซัลฟิวริกด้วยกรดไฮโดรคลอริก อย่างไรก็ตาม "อากาศที่ติดไฟได้" ไม่สนับสนุนการเผาไหม้ เช่นเดียวกับลมหายใจของสัตว์ที่พินาศอย่างรวดเร็วในชั้นบรรยากาศ จะพูดอะไรเกี่ยวกับการระเบิดของ "อากาศที่ติดไฟได้"? คุณสมบัตินี้ปรากฏเฉพาะเมื่อผสมกับอากาศล่วงหน้าเท่านั้น
การสังเกตเชิงคุณภาพอย่างหมดจดเหล่านี้เพียงอย่างเดียวก็เพียงพอแล้วที่จะยอมรับว่า "อากาศที่ติดไฟได้" ไม่มีส่วนเกี่ยวข้องกับอากาศธรรมดา ยกเว้นลักษณะที่เหมือนกัน หรือมากกว่า ยกเว้นการไม่มี "ประเภท" ใดๆ ในตัวทั้งสองเลย แต่สโลแกนของผู้วิจัยของเราคือ "ทุกอย่างถูกกำหนดโดยการวัด จำนวน และน้ำหนัก" ตามสโลแกนนี้ คาเวนดิชได้กำหนดปริมาตรของ "อากาศที่ติดไฟได้" ที่ปล่อยออกมาเมื่อโลหะที่แตกต่างกันจำนวนเท่ากันถูกละลายในกรด ในสัดส่วนของการผสม "อากาศที่ติดไฟได้" กับอากาศธรรมดาทำให้เกิดการระเบิด พลังที่ยิ่งใหญ่และสุดท้ายความถ่วงจำเพาะของ "อากาศที่ติดไฟได้" คืออะไร งานสุดท้ายนี้เขาทำสำเร็จด้วยการทดลองที่แยบยลในการออกแบบจนไม่สามารถส่งต่ออย่างเงียบๆ ได้
 |
คาเวนดิชชั่งน้ำหนักขวดด้วยกรดและสังกะสีอย่างระมัดระวัง ก่อนปฏิกิริยาระหว่างสารเหล่านี้ และหลังจากสังกะสีละลายจนหมด มีการสูญเสียน้ำหนักซึ่งตามคาเวนดิชเพียงสอดคล้องกับน้ำหนักของ "อากาศที่ติดไฟได้" ที่หลบหนี ในทางกลับกัน คาเวนดิชรู้จากการทดลองว่าควรปล่อย "อากาศที่ติดไฟได้" ออกมาในปริมาตรเท่าใดเมื่อสังกะสีที่มีน้ำหนักหนึ่งชิ้นถูกละลายจนหมด หารน้ำหนักที่ลดลงของขวดด้วยปริมาตรนี้ เขาได้สิ่งที่ต้องการ นั่นคือแรงโน้มถ่วงเฉพาะของ "อากาศที่ติดไฟได้" ซึ่งกลับกลายเป็นว่ามีขนาดเล็กผิดปกติ "ก๊าซที่ติดไฟได้" นั้นเบามาก แต่เบากว่าอากาศในบรรยากาศมาก ใหม่มาก คุณสมบัติที่สำคัญ"อากาศที่ติดไฟได้" ซึ่งในไม่ช้าก็อยู่ในมือของคนที่ยืนใกล้ชิดกับการปฏิบัติ ได้รับการใช้งานที่โดดเด่น
คาเวนดิชศึกษาคุณสมบัติอื่นๆ ของ "อากาศที่ติดไฟได้" อย่างขยันหมั่นเพียรและสม่ำเสมอ เช่นเดียวกับการวัดความแรงของเสียงระหว่างการระเบิดของส่วนผสมกับอากาศ ดูเหมือนว่านักสำรวจที่ไม่รู้จักเหน็ดเหนื่อยนี้ไม่ต้องการทิ้งอะไรไว้ให้คนอื่น อย่างไรก็ตาม คำถามที่ยากที่สุดที่เกี่ยวข้องกับ "อากาศที่ติดไฟได้" ยังคงไม่ได้รับคำตอบ "อากาศที่ติดไฟได้" มาจากไหน - โลหะหรือกรด? มันไปที่ไหนหรือดีกว่าที่จะบอกว่ามันจะเปลี่ยนเป็นอะไรระหว่างการเผาไหม้และการระเบิด?
ชมในที่สุด ชั่วโมงแห่งการไขปริศนานี้ก็มาถึง
สิบปีหลังจากการตีพิมพ์ผลงานของคาเวนดิช ในปี ค.ศ. 1766 นักวิจัยชื่อ Macke กำลังเผา "อากาศที่ติดไฟได้" ได้ตั้งข้อสังเกตที่น่าสนใจ เขาแนะนำจานรองจีนใน "อากาศที่ติดไฟได้" ซึ่งกำลังลุกไหม้อย่างเงียบๆ ที่คอขวด และที่เขาประหลาดใจก็คือพบว่าเปลวไฟนี้ไม่มีเขม่าบนจานรอง ในเวลาเดียวกัน เขาสังเกตเห็นอย่างอื่น: จานรองถูกปกคลุมด้วยของเหลวไม่มีสีเหมือนน้ำ เขาและผู้ช่วยตรวจสอบของเหลวที่เป็นผลอย่างระมัดระวังและพบว่าเป็นน้ำบริสุทธิ์จริงๆ
เปลวไฟที่ปราศจากควันและเขม่าเป็นปรากฏการณ์ที่น่าอัศจรรย์เกินกว่าที่จะไม่ก่อให้เกิดการโต้เถียง A. Lavoisier สงสัยว่าการเผาไหม้ของ "อากาศที่ติดไฟได้" ทำให้เกิดน้ำ เพื่อแก้ไขข้อสงสัยของเขา เขาได้เตรียมเรือขนาดใหญ่สองลำ โดยในจำนวนนั้นควรจะให้ "อากาศที่ติดไฟได้" และอีกลำหนึ่งคือออกซิเจน ก๊าซทั้งสองถูกส่งด้วยความช่วยเหลือของท่อที่มีก๊อกลงในฝาแก้วซึ่งควรจะเผา การทดลองที่สำคัญนี้ดำเนินการเมื่อวันที่ 24 มิถุนายน พ.ศ. 2326 ต่อหน้าบุคคลหลายคน ผลลัพธ์ก็ไม่น่าสงสัย
"น้ำที่ได้นั้นเชื่อฟังการทดสอบยืนยันทั้งหมดที่สามารถประดิษฐ์ได้" ตามที่ Lavoisier กล่าว "กลายเป็นน้ำบริสุทธิ์เหมือนกลั่น เธอไม่ได้ให้สีสกัดจากดอกทานตะวัน ไม่มีสารทำปฏิกิริยาที่รู้จักสามารถตรวจจับแม้กระทั่งร่องรอยของสิ่งเจือปนในนั้น ... ดังนั้น - Lavoisier สรุป - น้ำไม่มีอะไรมากไปกว่า "อากาศที่ติดไฟได้" ที่ถูกออกซิไดซ์ หรือกล่าวอีกนัยหนึ่ง , ผลิตภัณฑ์โดยตรงของการเผาไหม้ของ "อากาศที่ติดไฟได้" - ในออกซิเจนปราศจากแสงและความร้อนที่ปล่อยออกมาระหว่างการเผาไหม้
ในระหว่างการทดลอง ได้บรรยายถึงเลขานุการของ Royal Society of London ซึ่งบังเอิญอยู่ในปารีส เขารายงานว่าในอีกฟากหนึ่งของช่องแคบอังกฤษ ย้อนกลับไปในปี 1782 พวกเขาเผา "อากาศที่ติดไฟได้" ในพื้นที่ปิด และพบว่าสิ่งนี้ผลิตน้ำบริสุทธิ์จริงๆ ใครอยู่ข้างหน้านักเคมีชาวฝรั่งเศสที่โดดเด่น? ไม่มีใครอื่นนอกจากคาเวนดิช ผู้ซึ่งหลังจากผ่านไปเกือบยี่สิบปี กลับไปใช้ธีมเดิมของเขา วิธีการของเขาแตกต่างไปจากวิธีการของ Lavoisier เพียงอย่างเดียวตรงที่เขาไม่ได้เผาไฮโดรเจน แต่ระเบิดด้วยประกายไฟที่มีส่วนผสมของมันซึ่งมีปริมาตรมากกว่าอากาศ 2.5 เท่า เมื่อเป่าด้วยวิธีนี้ 500,000 เม็ด (1 เม็ด - ประมาณ 0.06 กรัม) ของ "อากาศที่ติดไฟได้" เขาสามารถรวบรวมน้ำได้มากถึง 135 เม็ดซึ่งไม่มีรสหรือกลิ่นและเมื่อระเหยจนแห้งก็ไม่ทิ้ง ตะกอนที่เห็นได้ชัดเจนน้อยที่สุด
โปรดทราบว่าไฮโดรเจนโดยทั่วไปติดไฟได้สูง หากเศษส่วนมวลของไฮโดรเจนในอากาศเท่ากับ 18–68% การระเบิดก็สามารถเกิดขึ้นได้ นี่เป็นสาเหตุของอุบัติเหตุร้ายแรงหลายครั้ง ตัวอย่างเช่น ในปี 1937 เรือเหาะที่ใหญ่ที่สุดในโลกคือ Hindenburg ได้ระเบิดและถูกไฟไหม้
คาเวนดิชที่เฉื่อยชาได้ตีพิมพ์รายงานของเขาในราชสมาคมแห่งลอนดอนในปี ค.ศ. 1784 ในขณะที่ลาวัวซิเยร์นำเสนอผลงานของเขาต่อหน้าสถาบัน Paris Academy of Sciences เมื่อวันที่ 25 มิถุนายน ค.ศ. 1783 ซึ่งนำหน้าคู่แข่งของเขาทั้งปี นอกจาก Lavoisier แล้ว คนอื่นๆ ยังได้มีส่วนร่วมในการค้นพบองค์ประกอบที่ซับซ้อนของน้ำ รวมถึง James Watt นักประดิษฐ์ชาวอังกฤษผู้โด่งดัง ซึ่งได้รับการยกย่องอย่างไม่ถูกต้องในต่างประเทศด้วยเกียรติในการประดิษฐ์เครื่องจักรไอน้ำ แต่ Lavoisier ได้แสดงความจริงที่ยิ่งใหญ่อย่างชัดเจนที่สุด: ต่อจากนี้ไป น้ำไม่ควรถูกมองว่าเป็นสารธรรมดา เพราะได้รับการพิสูจน์แล้วว่าเกิดจากการรวมกันของ "อากาศที่ติดไฟได้" กับ "อากาศที่สำคัญ"
อย่างไรก็ตาม Lavoisier ไม่ได้พิจารณาเรื่องนี้ ได้รับน้ำจากการสังเคราะห์ กล่าวคือ โดยการรวมองค์ประกอบที่ก่อตัวขึ้น เขาต้องการทำสิ่งที่ตรงกันข้าม - การวิเคราะห์ นั่นคือ การสลายตัวของน้ำให้เป็นธาตุ
เหล็กร้อนในโรงตีเหล็กถูกออกซิไดซ์ในอากาศ กล่าวคือ เพิ่มออกซิเจน ดูดออกซิเจนจากน้ำไม่ได้หรือ? ประสบการณ์พิสูจน์ความหวังนี้ เมื่อไอน้ำถูกส่งผ่านขี้เลื่อยเหล็กร้อนแดงที่วางอยู่ในกระบอกปืน ออกซิเจนจะรวมตัวกับเหล็กจริงๆ แล้ว "อากาศที่ติดไฟได้" จะถูกปล่อยออกมา
ดังนั้นการพิจารณาทางทฤษฎีจึงได้รับการยืนยันอย่างยอดเยี่ยมและระหว่างทางได้มีการค้นพบวิธีการใหม่ในการรับ "อากาศที่ติดไฟได้" แต่เรื่องไม่ได้จบเพียงแค่นั้น “เป็นไปไม่ได้หรือ” ลาวัวซิเยร์ถามตัวเอง “ตอนนี้จะดึงน้ำกลับมาโดยส่งผ่าน “อากาศที่ติดไฟได้” เหนือเหล็กออกไซด์ที่ร้อนจัด กล่าวคือ ทำให้ดึงออกซิเจนจากไอรอนออกไซด์แทนการรวมกับออกซิเจนอิสระ? และอีกครั้งที่ความคาดหวังของเขาได้รับการสวมมงกุฎด้วยความสำเร็จอย่างสมบูรณ์: เขาได้รับน้ำและเหล็กที่เป็นโลหะในรูปของผงที่ดีที่สุดอีกครั้ง
เป็นที่ทราบกันดีอยู่แล้วว่ามวลของอะตอมไฮโดรเจนนั้นน้อยกว่ามวลของเม็ดหลายเท่าของมวลของบุคคลซึ่งน้อยกว่ามวลของโลก และถ้าวางอะตอมไฮโดรเจน 100 ล้านอะตอมไว้ติดกัน จะเกิดเป็นสายโซ่ยาวเพียง 1 ซม.
การพิสูจน์องค์ประกอบที่ซับซ้อนของน้ำทำให้วงกลมของการค้นพบทางเคมีครั้งยิ่งใหญ่ที่เกิดขึ้นในศตวรรษที่ 18 เสร็จสมบูรณ์
เป็นผลให้ขอบเขตของวิทยาศาสตร์เคมีขยายกว้างและชี้แจงว่าจำเป็นต้องแทนที่ชื่อเก่าสุ่มและไม่สอดคล้องกันของสารต่าง ๆ ด้วยชื่อใหม่ที่จะบ่งบอกถึงความสัมพันธ์ซึ่งกันและกันของสารเหล่านี้ความสัมพันธ์ทางเคมีของพวกมัน
* ออนซ์เป็นหน่วยมวลที่ไม่ใช่เมตริกในประเทศที่พูดภาษาอังกฤษ ประมาณ 0.03 ก. ( บันทึก. เอ็ด)
เป็นก๊าซซึ่งมีความสำคัญในการดำรงอยู่ของสิ่งมีชีวิตบนโลกเมื่อหลายพันล้านปีก่อน ตามการคาดเดาในปัจจุบัน ไฮโดรเจน (H2) ปรากฏขึ้นเมื่อประมาณ 14 พันล้านปีก่อน ไม่มีสีหรือกลิ่น และเป็นธาตุที่เบาที่สุดในตารางธาตุเคมี โดยมีมวลอะตอมอยู่ที่ 1.00794 ไฮโดรเจนมีโครงสร้างผลึกหกเหลี่ยมและที่อุณหภูมิ 0 องศาเซลเซียสมีความหนาแน่น 0.09099 กรัม/ลิตร
ถือได้ว่าเป็นก๊าซ "ชนชั้นสูง" เนื่องจากมันถูกค้นพบในปี พ.ศ. 2309 โดยนักปรัชญาชาวอังกฤษ นักฟิสิกส์ และนักเคมีที่มีเกียรติอย่าง Henry Cavendish และได้รับชื่อในปี พ.ศ. 2326 ต้องขอบคุณนักฟิสิกส์ชาวฝรั่งเศส อองตวน ลาวัวซิเยร์ . ลอร์ดคาเวนดิชชอบเรียกการค้นพบของเขาว่า "อากาศที่ติดไฟได้" ลอร์ดคาเวดิชผู้มั่งคั่งอย่างน่าอัศจรรย์ขี้อายและถอนตัวออกไปจนหนึ่งในที่ดินของเขามีบันไดแยกไปที่ทางเข้าเนื่องจากเขาไม่สามารถสื่อสารกับคนรับใช้โดยเฉพาะผู้หญิงซึ่งเขาขี้อายเป็นพิเศษและสื่อสารผ่านโน้ตเท่านั้น ตามสมมติฐานสมัยใหม่ Henry Cavendish ได้รับความทุกข์ทรมานจากโรค Asperger's
สำหรับ Antoine Lavoisier จุดจบของเขาน่าเศร้า: หลังจากงานทางวิทยาศาสตร์ที่สำคัญทั้งหมดเขาถูกชาวนาฝรั่งเศสกีดกันศีรษะของเขาด้วยความช่วยเหลือของกิโยตินระหว่างการปฏิวัติฝรั่งเศส ไม่กี่สัปดาห์หลังจากเหตุการณ์ที่เกิดขึ้น พวกเขายอมรับความผิดพลาดและขอโทษครอบครัวของ Antoine Lavoisier และต่อมาก็สร้างรูปปั้นเพื่อเป็นเกียรติแก่เขา แต่เนื่องจากขาดเงินทุน หัวหน้าของสุภาพบุรุษอีกคนหนึ่งจึงติดอยู่กับรูปปั้นลาวัวซิเยร์ มันดูค่อนข้างแดกดันใช่มั้ย?
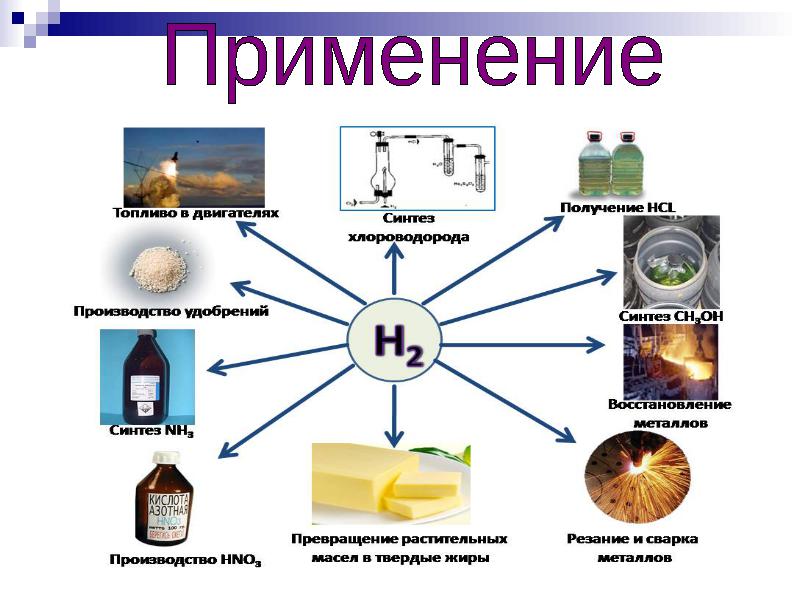
การปรับตัวนั้นยอดเยี่ยมมาก ไฮโดรเจนสามารถผลิตกระแสไฟฟ้าได้ ซึ่งเป็นสาเหตุที่ทำให้ใช้ในเซลล์เชื้อเพลิงและเป็นตัวเลือกที่สะอาดที่สุดในเครื่องยนต์สันดาปภายใน
ไฮโดรเจนเกิดขึ้นจากการระเบิดของบิ๊กแบง และตั้งแต่นั้นมา ก็มีการดำเนินงานในทรงกลมต่างๆ บนโลก ในช่วงสามและครึ่งพันล้านปีที่ผ่านมา บริษัทได้มีส่วนร่วมอย่างแข็งขันในการผลิตน้ำ ตลอดจนการกำเนิดและการบำรุงรักษาชีวิตเซลล์
ทุกวันนี้ ไฮโดรเจน (H2) อยู่ภายใต้การพิจารณาอย่างถี่ถ้วนในการวิจัยทางการแพทย์ การศึกษาทางวิทยาศาสตร์หลายร้อยชิ้นได้พิสูจน์ศักยภาพการรักษาของน้ำที่อุดมด้วยไฮโดรเจนสำหรับแบบจำลองโรคต่างๆ มากกว่า 140 แบบ
ต่อไปนี้คือภาพรวมโดยย่อของความเป็นไปได้ในการรักษาบางอย่างของไฮโดรเจนและน้ำไฮโดรเจน:
- ลดแรงตึงผิวของเซลล์ ทำให้เซลล์ดูดซับสารอาหารได้ดีขึ้น
- นี่เป็นตัวที่เล็กที่สุดที่มีการดูดซึมสูง
- ไฮโดรเจนจะกำจัดเฉพาะสารที่ทำลายล้างมากที่สุดเท่านั้น และเปลี่ยนเป็นน้ำที่ปลอดภัยโดยไม่มีของเสียที่เป็นพิษ
- เสริมการทำงานของสารต้านอนุมูลอิสระ เช่น กลูตาไธโอน และซูเปอร์ออกไซด์ ดิสมิวเตส
- ช่วยในการใช้ความชุ่มชื้นที่เหมาะสมของเซลล์
- น้ำไฮโดรเจนช่วยลดกรดแลคติกและบรรเทาอาการปวดกล้ามเนื้อระหว่างและหลังการออกกำลังกาย
- ส่งเสริมการผลิต ATP ในไมโตคอนเดรีย
- น้ำไฮโดรเจนช่วยเพิ่มการทำงานของไมโตคอนเดรียในสมอง ซึ่งจะช่วยปรับปรุงการทำงานของสมอง ยังรักษาสมดุลของน้ำตาลและคอเลสเตอรอล
- น้ำไฮโดรเจนมีฤทธิ์ต้านการอักเสบและป้องกันอันตรายจากรังสี ดังนั้นการใช้งานจึงถูกกำหนดโดยนักบินอวกาศในระหว่างเที่ยวบิน
- มีฤทธิ์ต้านการแพ้
อ่านบทความ
บทเรียนนี้อุทิศให้กับการศึกษาคุณสมบัติทางกายภาพและวิธีการได้ก๊าซไฮโดรเจนที่เบาที่สุด บทเรียนนี้กล่าวถึงประวัติการค้นพบไฮโดรเจน หลังจากศึกษาเนื้อหาในบทเรียนแล้ว คุณจะได้เรียนรู้วิธีแยกแยะไฮโดรเจนจากสารก๊าซอื่นๆ
หัวข้อ: สสารและการเปลี่ยนแปลงของพวกมัน
บทเรียน:ประวัติความเป็นมาของการค้นพบไฮโดรเจน การได้มาและคุณสมบัติทางกายภาพของไฮโดรเจน
ตั้งแต่สมัยโบราณ ผู้คนรู้จักสารที่สามารถละลายโลหะบางชนิดได้ สารละลายที่อ่อนแอของสารเหล่านี้มีรสเปรี้ยวจึงเรียกว่า "กรด" ตัวอย่างเช่น กรดซิตริกพบได้ในมะนาว กรดมาลิกในแอปเปิ้ล สารที่มีสูตรทางเคมี H 2 SO 4 เรียกว่า กรดซัลฟิวริก
นักวิจัยหลายคนได้ทดลองกับกรด สังเกตได้ว่าเมื่อกรดทำปฏิกิริยากับโลหะบางชนิด จะเกิดฟองแก๊สออกมา ก๊าซที่ได้นั้นติดไฟได้สูงและถูกเรียกว่า "อากาศที่ติดไฟได้"
คุณสมบัติของก๊าซนี้ได้รับการศึกษาโดยละเอียดโดยนักวิทยาศาสตร์ชาวอังกฤษ G. Cavendish ในปี ค.ศ. 1766 เขาวางโลหะในสารละลายของกำมะถันและ กรดไฮโดรคลอริกและในทุกกรณีได้รับสารก๊าซชนิดเดียวกันซึ่งต่อมาเรียกว่าไฮโดรเจน
ให้เรายกตัวอย่างสมการของปฏิกิริยาของปฏิกิริยาของโลหะกับกรดในระหว่างที่เกิดไฮโดรเจน เมื่อเหล็กทำปฏิกิริยากับกรดไฮโดรคลอริก จะเกิดเหล็ก (II) คลอไรด์และไฮโดรเจนขึ้น เมื่อเหล็กทำปฏิกิริยากับสารละลายของกรดซัลฟิวริก จะเกิดเหล็กซัลเฟต (II) FeSO 4 และไฮโดรเจนขึ้น โปรดทราบว่าในปฏิกิริยาทั้งสอง ไฮโดรเจนจะถูกปล่อยออกจากสารละลายตามที่ระบุโดยลูกศร
ข้าว. 1. ปฏิกิริยาของเหล็กกับกรดไฮโดรคลอริก

ข้าว. 2. ปฏิกิริยาของเหล็กกับสารละลายกรดซัลฟิวริก
ปฏิกิริยาที่แสดงไม่อ้างอิงถึงชนิดของสารประกอบหรือชนิดของการแทนที่ ในแต่ละปฏิกิริยาเหล่านี้ สารธรรมดาหนึ่งชนิดและสารเชิงซ้อนหนึ่งชนิดจะป้อน และเกิดสารเชิงซ้อนและสารเชิงซ้อนใหม่ขึ้น ปฏิกิริยาดังกล่าวเรียกว่าปฏิกิริยาการแทนที่
โลหะบางชนิดสามารถแทนที่ไฮโดรเจนในกรดได้
ดังนั้นกรดจึงเป็นสารที่มีไฮโดรเจนซึ่งสามารถแทนที่ด้วยโลหะได้
ชื่อ "ไฮโดรเจน" มาจากภาษากรีก คำว่า "gidor" - น้ำและ "genao" - ฉันให้กำเนิดเช่น "ให้กำเนิดน้ำ" แท้จริงแล้ว เมื่อไฮโดรเจนถูกเผาไหม้ น้ำก็ก่อตัวขึ้น ชื่อนี้ได้รับการแนะนำโดย A. Lavoisier ในปี ค.ศ. 1779
ไฮโดรเจนเป็นองค์ประกอบทางเคมีที่มีมากที่สุดในจักรวาลและเป็นองค์ประกอบหลักของดาวฤกษ์ ไฮโดรเจนองค์ประกอบทางเคมีเป็นส่วนหนึ่งของพืชและสัตว์ทั้งหมด รวมทั้งองค์ประกอบของสารที่พบบ่อยที่สุดบนโลก - น้ำ
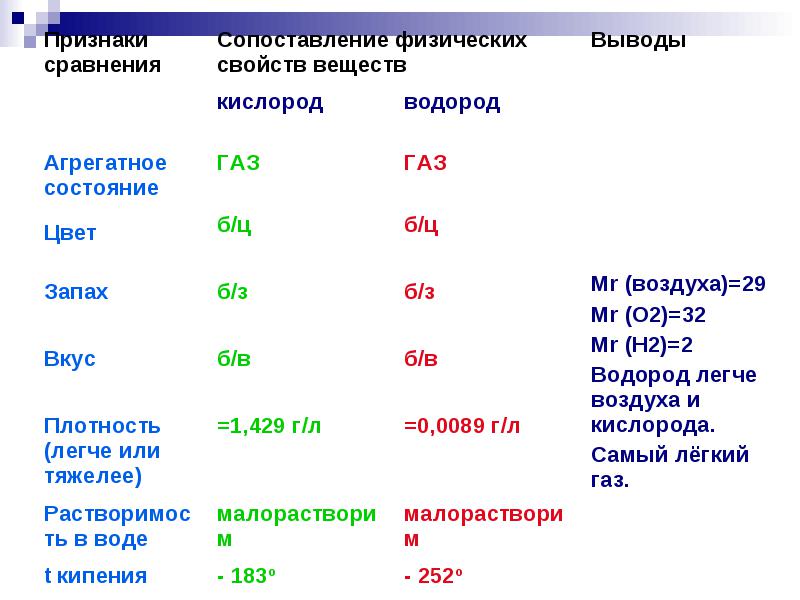
ไฮโดรเจนสารอย่างง่ายมีสูตร H2 . เป็นสารที่เป็นก๊าซ ไม่มีรส ไม่มีกลิ่น ละลายได้เล็กน้อยในน้ำ จุดเดือดของไฮโดรเจนคือ -253°C ไฮโดรเจนเป็นก๊าซที่เบาที่สุดในบรรดาสารที่เป็นก๊าซ โดยเบากว่าอากาศ 14.5 เท่า
2. รับไฮโดรเจนและตรวจสอบความบริสุทธิ์ ()
การบ้าน
1) กับ. 76-78 №№ 2,3,5,6,9จากหนังสือวิชาเคมี ป.8 สู่ตำรา ป.อ. Orzhekovsky และอื่น ๆ “ เคมี เกรด 8” / O.V. Ushakova, P.I. Bespalov, P.A. ออร์เจคอฟสกี; ภายใต้. เอ็ด ศ. ป. Orzhekovsky - M .: AST: Astrel: Profizdat, 2006
2) หน้า 140-141 หมายเลข 2,6จากตำราป. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova "เคมี: เกรด 8", 2013
1ประวัติความเป็นมาของการค้นพบไฮโดรเจน คุณสมบัติทางกายภาพและทางเคมี. วิธีการผลิตไฮโดรเจน
ภาษิต บทเรียน:
การจะเป็นนักเคมีตัวจริง คุณต้องรู้ คิดได้!”

Epigraph ของบทเรียน:
“สำหรับคนที่รู้น้อย
และนี่คือมาก
และสำหรับใครที่อยากทราบมากๆ
และนั่นยังไม่พอ"


คำถาม:
เกี่ยวกับการค้นพบก๊าซที่เป็นปัญหา
ใครเป็นผู้ค้นพบก๊าซนี้?
คุณสมบัติทางกายภาพของ O2 ใดที่กล่าวถึงในบทกวี
สารใดที่เกิดขึ้นระหว่างการเกิดออกซิเดชัน (ออกไซด์)
ออกไซด์คืออะไร?
ออกไซด์ใดถูกใช้เพื่อค้นหาออกซิเจน

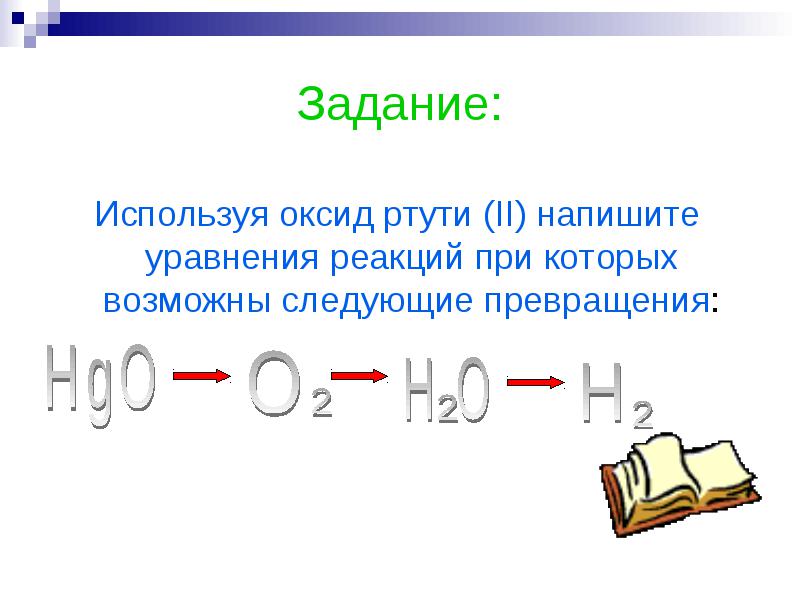
ออกกำลังกาย:
ใช้ปรอท (II) ออกไซด์ เขียนสมการปฏิกิริยาที่เป็นไปได้ในการแปลงต่อไปนี้:
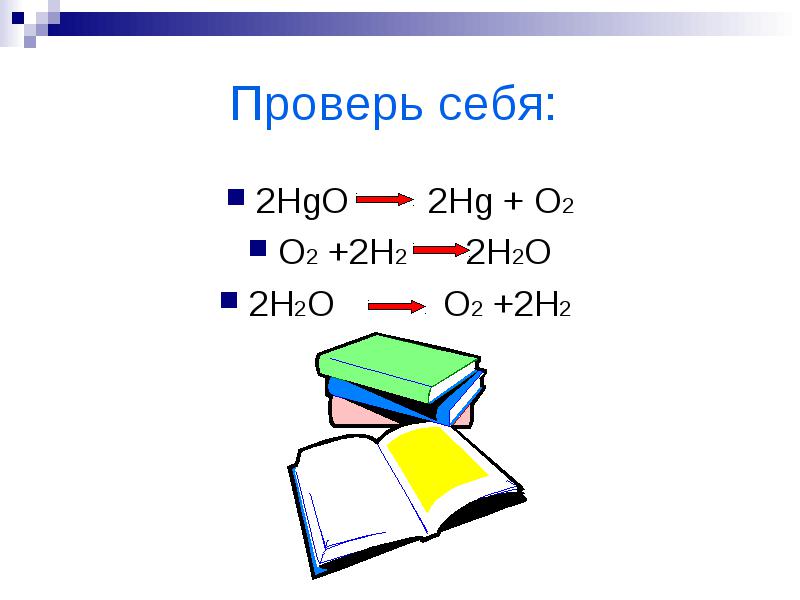
ตรวจสอบตัวเอง:
2HgO 2Hg + O2
O2 +2H2 2H2O
2H2O O2 +2H2
.
เป้า:
ทำความรู้จักกับการกระจายไฮโดรเจนในธรรมชาติ
เรียนรู้เกี่ยวกับประวัติการค้นพบไฮโดรเจน
เพื่อศึกษาคุณสมบัติทางกายภาพและเคมีของไฮโดรเจนเปรียบเทียบกับออกซิเจน
พิจารณาการใช้งานหลักของไฮโดรเจน


เปลือกโลก
(เศษส่วนมวล)



การแพร่กระจายบนโลก
น้ำ - H2O
มีเทน - CH4 ไฮโดรเจนซัลไฟด์ -
การแพร่กระจายในจักรวาล
ไฮโดรเจนเป็นธาตุที่มีมากที่สุดในจักรวาล
คิดเป็นประมาณ 92% ของอะตอมทั้งหมด
(8% เป็นอะตอมฮีเลียม ส่วนแบ่งขององค์ประกอบอื่น ๆ ที่นำมารวมกันน้อยกว่า 0.1%)
ไฮโดรเจนเป็นองค์ประกอบหลักของดาวฤกษ์และก๊าซระหว่างดวงดาว
ที่อุณหภูมิดาวฤกษ์ ไฮโดรเจนมีอยู่ในรูปของพลาสมา
ในอวกาศระหว่างดวงดาว ธาตุนี้มีอยู่ในรูปของโมเลกุล อะตอม และไอออนแต่ละตัว
และสามารถสร้างเมฆโมเลกุลที่มีขนาด ความหนาแน่น และอุณหภูมิแตกต่างกันอย่างมาก

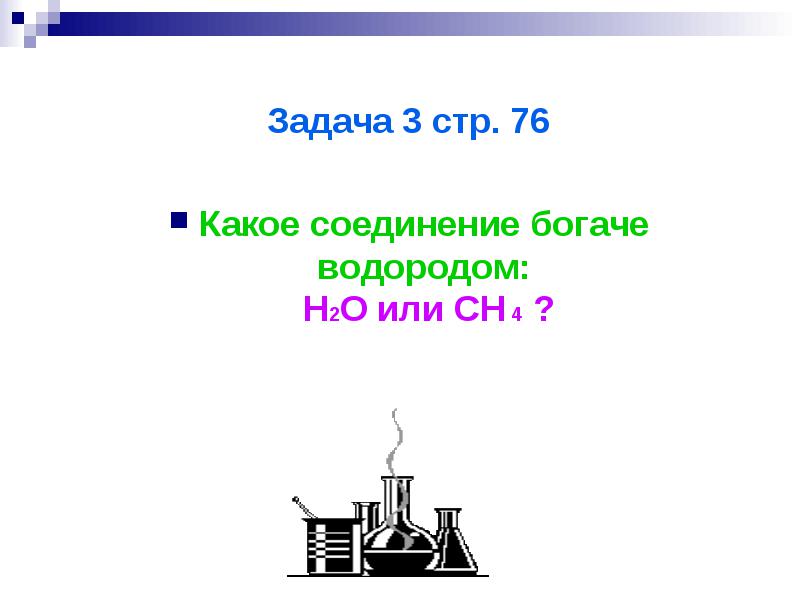
งาน 3 หน้า 76
สารประกอบใดมีไฮโดรเจนมากกว่า: H2O หรือ CH4
ทดสอบตัวเอง: วิธีแก้ปัญหา


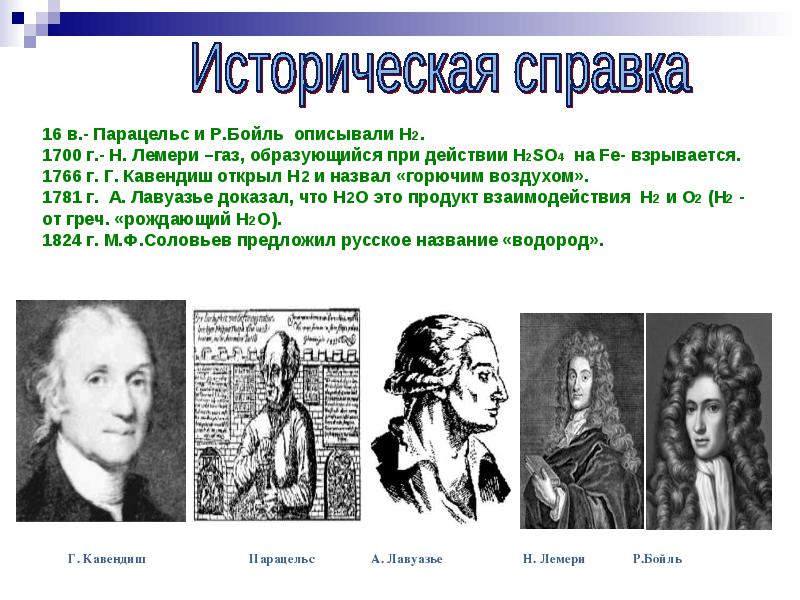
ศตวรรษที่ 16 - Paracelsus และ R. Boyle อธิบาย H2 1700 - N. Lemery - แก๊สที่เกิดจากการกระทำของ H2SO4 บน Fe - ระเบิด 1766 G. Cavendish ค้นพบ H2 และเรียกมันว่า "อากาศที่ติดไฟได้" ในปี ค.ศ. 1781 A. Lavoisier ได้พิสูจน์ว่า H2O เป็นผลจากปฏิสัมพันธ์ของ H2 และ O2 (H2 - จากภาษากรีก "ให้กำเนิด H2O") พ.ศ. 2367 โซโลวีฟเสนอชื่อรัสเซียว่า "ไฮโดรเจน"
นักฟิสิกส์และนักเคมีชาวอังกฤษชื่อ G.Kavedish ศึกษาก๊าซนี้ในปี 1766 และเรียกมันว่า "อากาศที่ติดไฟได้" เมื่อถูกเผา "อากาศที่ติดไฟได้" จะผลิตน้ำ แต่การที่คาเวนดิชยึดมั่นในทฤษฎีโฟลจิสตันทำให้เขาไม่สามารถสรุปผลที่ถูกต้องได้

นักเคมีชาวฝรั่งเศส A. Lavoisier ร่วมกับวิศวกร J. Meunier โดยใช้เครื่องวัดก๊าซแบบพิเศษในปี 1783 ได้ทำการสังเคราะห์น้ำ และจากนั้นทำการวิเคราะห์ สลายไอน้ำด้วยเหล็กร้อนแดง ดังนั้น เขาจึงกำหนดว่า "อากาศที่ติดไฟได้" เป็นส่วนหนึ่งของน้ำและสามารถหาได้จากมัน ในปี ค.ศ. 1787 ลาวัวซิเยร์ได้ข้อสรุปว่า "อากาศที่ติดไฟได้" เป็นสารธรรมดาและดังนั้นจึงเป็นองค์ประกอบทางเคมีจำนวนหนึ่ง เขาตั้งชื่อมันว่าไฮโดรเจน (จากภาษากรีก hydor - น้ำและ gennao - ให้กำเนิด) - "ให้กำเนิดน้ำ"
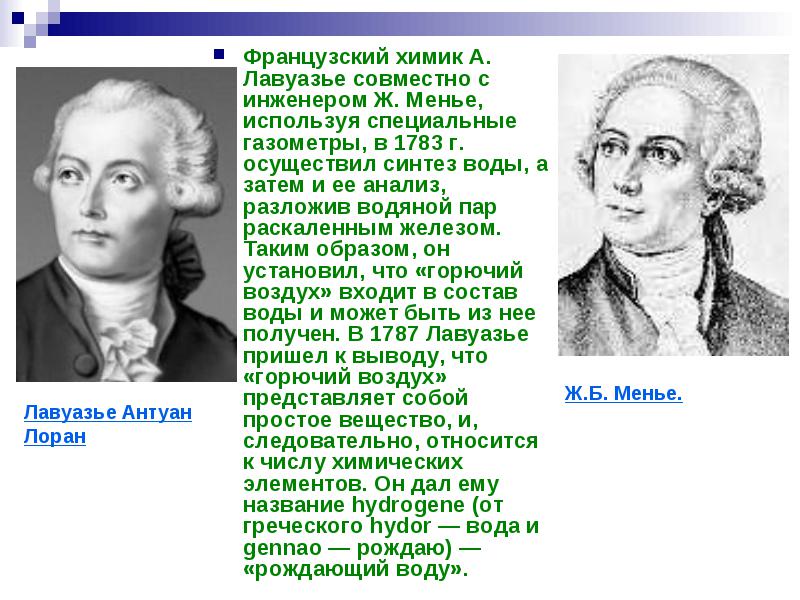
ศตวรรษก่อตั้งขึ้น
ชื่อรัสเซีย "ไฮโดรเจน" ถูกเสนอโดยนักเคมี M.F. Solovyov ในปี 1824 ในช่วงเปลี่ยนศตวรรษที่ 18 และ 19 พบว่าอะตอมไฮโดรเจนมีน้ำหนักเบามาก (เมื่อเทียบกับอะตอมของธาตุอื่นๆ) และนำน้ำหนัก (มวล) ของอะตอมไฮโดรเจนมาเป็นหน่วยเปรียบเทียบมวลอะตอม ขององค์ประกอบ มวลของอะตอมไฮโดรเจนมีค่าเท่ากับ 1

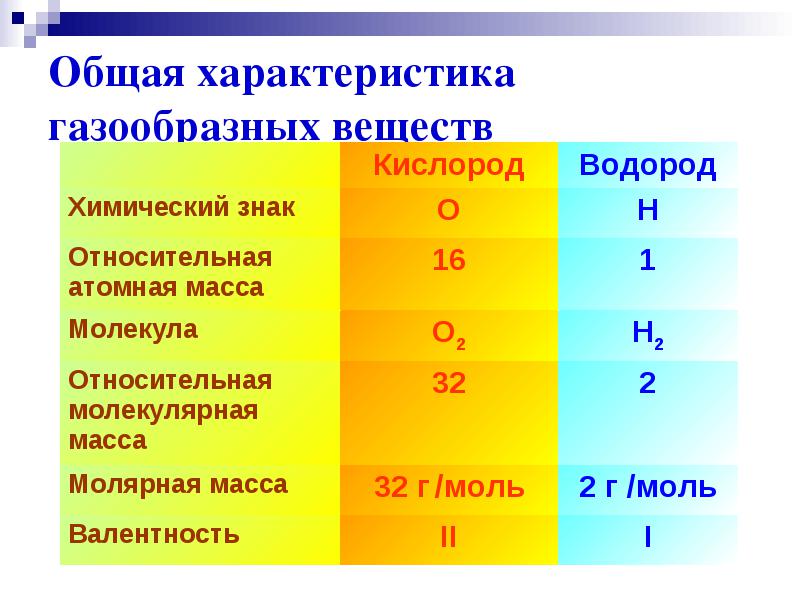
คุณสมบัติทางกายภาพของไฮโดรเจน
โมเลกุลไฮโดรเจนเป็นไดอะตอมมิก - H 2 .
ภายใต้สภาวะปกติจะเป็นก๊าซไม่มีสี ไม่มีกลิ่น และรสจืด
ความหนาแน่น 0.08987 g/l (N.O.),
จุดเดือด −252.76 °C,
ละลายได้เล็กน้อยในน้ำ - 18.8 มล. / ลิตร
ม(H 2 )=2g/โมล
Valence I


ลักษณะทั่วไปของสารที่เป็นก๊าซ
นาทีพลศึกษา

ปริศนา:
ก๊าซที่เบาที่สุดในโลก
และมันอยู่ในกาแล็กซี่
ในบอลลูนที่มีแก๊ส
คุณสามารถบินไปยังดวงดาว
_____________________________
เราไม่สามารถอยู่ได้โดยปราศจากมัน
เขาจะช่วยพวกเราทุกคนเสมอ
เขาอยู่ทุกที่ -
ทั้งบนบกและในน้ำ
ใครในพวกคุณจะบอกฉัน
ชื่อก๊าซนี้คืออะไร?
____________________________
ในวิหาร Mendeleev
ฉันอาศัยอยู่ชั้นบน
ในโถงทางเดินต่างๆ
ฉันมีอพาร์ทเมนท์สองห้อง
และเป็นที่หนึ่ง!
เป็นนายแบบที่ฉันเป็น!

เครื่องคิป


ปฏิกิริยาของสังกะสีกับกรดไฮโดรคลอริก




คุณสมบัติของการจัดการไฮโดรเจน
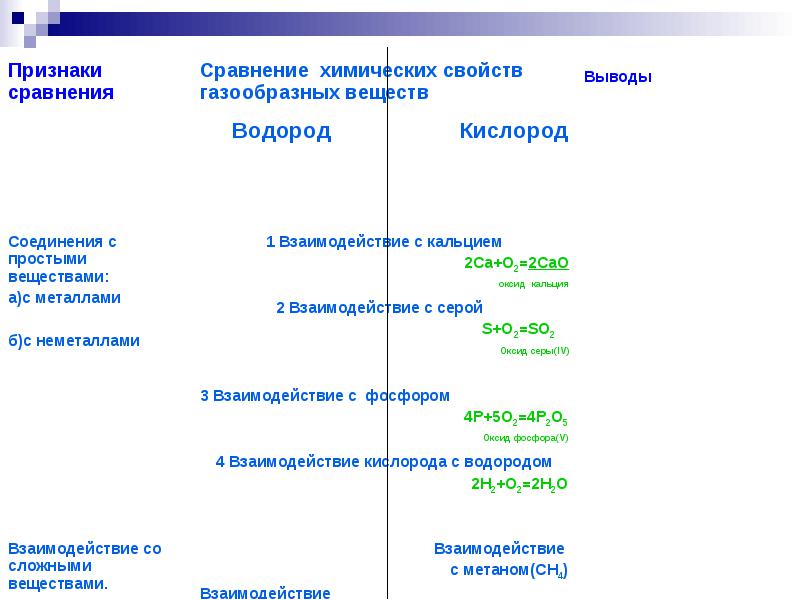
ไฮโดรเจนเมื่อผสมกับอากาศจะเกิดส่วนผสมที่ระเบิดได้ ซึ่งเรียกว่าแก๊สระเบิด
อันตรายจากการระเบิดสูงสุดที่อัตราส่วนปริมาตรของไฮโดรเจนและออกซิเจน 2: 1
หรือไฮโดรเจนกับอากาศประมาณ 2:5
ไฮโดรเจนยังติดไฟได้
ไฮโดรเจนเหลวอาจทำให้เกิดอาการบวมเป็นน้ำเหลืองอย่างรุนแรงหากสัมผัสกับผิวหนัง
ความเข้มข้นของไฮโดรเจนกับออกซิเจนที่ระเบิดได้เกิดขึ้นจาก 4% ถึง 96% โดยปริมาตร
เมื่อผสมกับอากาศตั้งแต่ 4% ถึง 75(74)% โดยปริมาตร

Andrei Dmitrievich Sakharov 21 พฤษภาคม 2464 - 14 ธันวาคม 2532

การเขียนตามคำบอกทางเคมี:
หมายเลข 8 บรรทัดในคอลัมน์ เขียนสูตรของก๊าซที่ต้องการถัดจากตัวเลขแต่ละตัว
1. แก๊สเบา
2. แก๊สหนัก
3. ก๊าซสนับสนุนการเผาไหม้
4. แก๊สเมื่อผสมกับออกซิเจนจะระเบิดภายใต้สภาวะปกติ
5. รวบรวมโดยการกระจัดของอากาศ
6. รวบรวมในเรือพลิกคว่ำ
7. การเก็บเกี่ยวโดยการกำจัดน้ำ
8. รวบรวมในภาชนะที่วางอยู่ด้านล่าง

คำตอบที่ถูกต้อง:
1) คะแนน H2:
2) O2 "5" -10-9 หลุม
3) O2. "4" - 8-7 หลุม
4) H2 "3" - 6-4 รู
5) H2, O2
6) H2.
7) O2, H2
8) O2.


ทดสอบ:
ทดสอบ:
1. เปรียบเทียบก๊าซและคุณสมบัติของพวกมัน:
ก) ไฮโดรเจน 1) มีส่วนร่วมในกระบวนการเผาไหม้และการหายใจเอง
B) ออกซิเจน 2) ก๊าซที่เบาที่สุดที่ทำปฏิกิริยากับออกซิเจน
เกิดเป็นน้ำ
_______________________________________________________
2. คุณสมบัติใดต่อไปนี้ของไฮโดรเจนที่มีทางกายภาพ:
ก) ก๊าซที่เบาที่สุด
B) ไม่มีกลิ่นและสี
B) เผาไหม้ด้วยเปลวไฟ
D) ละลายได้เล็กน้อยในน้ำ
____________________________________________________________
3. สมบัติทางการระเบิดมีส่วนผสมของ
ก) ออกซิเจนและไฮโดรเจน
B) ออกซิเจนและไนโตรเจน
B) คาร์บอนไดออกไซด์และออกซิเจน
ง) ไฮโดรเจนและคาร์บอนไดออกไซด์

คำตอบที่ถูกต้อง:
1. เกรด A-2:
B-1 "5" - 6 รู
___________ "4" -5-4 รู
2. A, B, G "3" -3 รู
____________
งานเป็นเรื่องลึกลับ
การทดลองทั้งหมดถูกเลื่อนออกไป
การคำนวณถูกขัดจังหวะ
เช้าวันเดินทางไกล
นักวิทยาศาสตร์ไป
และทันใดนั้น…
หมวกถูกโยนเข้ามุม!
เขารีบไปที่โต๊ะ!
เขาเขียนอะไรก็ได้
ไม่ได้ยินอะไรรอบตัว
ป้องกันการระเบิดที่น่ากลัว"
นักวิทยาศาสตร์เขียนอะไรถึงเพื่อนร่วมงานของเขาในข้อความนี้

ภารกิจคือปริศนา
S S D O D A S K I S
M E V O R O D O R O L
CH A T A M O M I L I
V Y R Z V X U D Z O V

ตรวจสอบตัวเอง:
"ส่วนผสมของไฮโดรเจนและออกซิเจน
หรือระเบิดอากาศ


หน้า 25-27;
หน้า 25-27;
แบบฝึกหัด 5.9 หน้า 77
งานสร้างสรรค์ "ทำไมไฮโดรเจนถึงเรียกว่าเชื้อเพลิงแห่งอนาคต"
เขียนปริศนาเกี่ยวกับไฮโดรเจน



ส่งงานที่ดีของคุณในฐานความรู้เป็นเรื่องง่าย ใช้แบบฟอร์มด้านล่าง
นักศึกษา นักศึกษาระดับบัณฑิตศึกษา นักวิทยาศาสตร์รุ่นเยาว์ที่ใช้ฐานความรู้ในการศึกษาและการทำงานจะขอบคุณอย่างยิ่ง
โพสต์เมื่อ http://www.allbest.ru/
กระทรวงศึกษาธิการและวิทยาศาสตร์แห่งแคว้นสะมารา
ผู้เชี่ยวชาญอิสระของรัฐ
สถาบันการศึกษาของภูมิภาค Samara
วิทยาลัยรัฐซามารา
ข้อความบนหัวข้อ:
« เรื่องราวการค้นพบไฮโดรเจน»
ทำโดยนักเรียน
กาปู "เอสจีเค"
กลุ่ม ATP-16-01
Gubanov Vitaly Alekseevich
Samara, 2016
นักวิจัยหลายคนได้ทดลองกับกรด สังเกตได้ว่าเมื่อกรดทำปฏิกิริยากับโลหะบางชนิด จะเกิดฟองแก๊สออกมา ก๊าซที่ได้นั้นติดไฟได้สูงและถูกเรียกว่า "อากาศที่ติดไฟได้"
คุณสมบัติของก๊าซนี้ได้รับการศึกษาโดยละเอียดโดยนักวิทยาศาสตร์ชาวอังกฤษ G. Cavendish ในปี ค.ศ. 1766 เขาวางโลหะลงในสารละลายของกรดซัลฟิวริกและกรดไฮโดรคลอริก และในทุกกรณีก็ได้รับสารก๊าซเบาชนิดเดียวกัน ซึ่งต่อมาเรียกว่าไฮโดรเจน
นักวิทยาศาสตร์ชาวอังกฤษ Henry Cavendish เคยหยิบสิ่งแปลก ๆ ขึ้นมาในแวบแรก: เขาเริ่มเป่าฟองสบู่ แต่มันไม่สนุก ก่อนหน้านั้น เขาสังเกตเห็นว่าเมื่อตะไบเหล็กราดด้วยกรดซัลฟิวริก จะเกิดฟองของก๊าซบางชนิดขึ้น ก๊าซนี้คืออะไร?
นักวิทยาศาสตร์พาเขาออกจากเรือผ่านท่อ ก๊าซที่มองไม่เห็น มันมีกลิ่นหรือไม่? เลขที่ จากนั้นเขาก็เติมฟองสบู่ให้พวกเขา พวกเขาขึ้นไปอย่างง่ายดาย! ก๊าซจึงเบากว่าอากาศ! และถ้าคุณจุดไฟให้กับแก๊ส มันจะสว่างขึ้นด้วยแสงสีน้ำเงิน แต่ที่อัศจรรย์คือเมื่อถูกเผาจะได้น้ำมา! Henry Cavendish ตั้งชื่อก๊าซที่ติดไฟได้ใหม่ ท้ายที่สุดเขาก็เหมือนกับอากาศธรรมดาที่ไม่มีสีและไม่มีกลิ่น ทั้งหมดนี้เกิดขึ้นในช่วงครึ่งหลังของศตวรรษที่ 18
ต่อมา นักเคมีชาวฝรั่งเศส อองตวน โลรองต์ ลาวัวซิเยร์ ทำสิ่งที่ตรงกันข้าม เขาได้รับ "ก๊าซที่ติดไฟได้" จากน้ำ เขายังตั้งชื่อก๊าซใหม่อีกชื่อหนึ่งว่า ไฮโดรเจน นั่นคือ "การให้กำเนิดน้ำ" จากนั้นนักวิทยาศาสตร์ก็พบว่าไฮโดรเจนนั้นเบาที่สุด คนรู้จักสสารและอะตอมของมันง่ายกว่าสิ่งอื่นทั้งหมด
ไฮโดรเจนเป็นเรื่องธรรมดามาก เป็นส่วนหนึ่งของสิ่งมีชีวิต สิ่งมีชีวิต พืช หิน. มันมีอยู่ทุกหนทุกแห่ง ไม่เพียงแต่บนโลกเท่านั้น แต่ยังอยู่บนดาวเคราะห์และดวงดาวอื่นๆ บนดวงอาทิตย์ด้วย โดยเฉพาะในอวกาศ การเปลี่ยนแปลงที่เกิดขึ้นกับไฮโดรเจนที่ความดันมหึมาและอุณหภูมิหลายสิบล้านองศาทำให้ดวงอาทิตย์สามารถแผ่ความร้อนและแสงได้ ไฮโดรเจนสร้างสารประกอบต่างๆ ที่มีคาร์บอนมากที่สุด ได้แก่ น้ำมันและหินน้ำมัน น้ำมันเบนซิน และแอสฟัลต์สีดำ สารประกอบดังกล่าวเรียกว่าไฮโดรคาร์บอน ไฮโดรเจนใช้กันอย่างแพร่หลายในการเชื่อมและตัดโลหะ หากเติมออกซิเจนลงในสารประกอบคาร์บอนและไฮโดรเจน ก็จะได้สารประกอบใหม่ เช่น คาร์โบไฮเดรต สารที่ไม่เหมือนกัน เช่น แป้งและน้ำตาล และถ้าคุณรวมไฮโดรเจนกับไนโตรเจน คุณก็จะได้ก๊าซ - แอมโมเนีย จำเป็นสำหรับการผลิตปุ๋ย ข้อดีหลายประการของไฮโดรเจน ซึ่งเป็นมิตรกับสิ่งแวดล้อม ใช้พลังงานมาก และมีธรรมชาติมากมาย ทำให้สามารถใช้เป็นเชื้อเพลิงจรวดได้ คุณสมบัติเดียวกันของไฮโดรเจนทำให้มีแนวโน้มว่าจะเป็นเชื้อเพลิงสำหรับการบิน
ไฮโดรเจนเป็นองค์ประกอบทางเคมีที่เบาที่สุด เรียบง่ายที่สุด และมีมากที่สุดในจักรวาล มันคิดเป็นประมาณ 75% ของมวลรวมขององค์ประกอบในนั้น ไฮโดรเจนมีอยู่ในปริมาณมากในดาวฤกษ์และดาวเคราะห์ก๊าซยักษ์ มันมีบทบาทสำคัญในปฏิกิริยาฟิวชันที่เกิดขึ้นในดวงดาว ไฮโดรเจนเป็นก๊าซที่มีสูตรโมเลกุล H2 ที่อุณหภูมิห้องและ ความดันปกติไฮโดรเจนเป็นก๊าซที่ไม่มีรส ไม่มีสี และไม่มีกลิ่น ภายใต้ความกดดันและเย็นจัด ไฮโดรเจนจะกลายเป็นของเหลว ไฮโดรเจนที่เก็บไว้ในสถานะนี้ใช้พื้นที่น้อยกว่าในรูปก๊าซ "ปกติ" ไฮโดรเจนเหลวยังใช้เป็นเชื้อเพลิงจรวดอีกด้วย ที่ความดันสูงมาก ไฮโดรเจนจะแข็งตัวและกลายเป็นไฮโดรเจนที่เป็นโลหะ กำลังดำเนินการวิจัยในทิศทางนี้ ไฮโดรเจนถูกใช้เป็นเชื้อเพลิงทางเลือกในการขนส่ง พลังงานเคมีของไฮโดรเจนจะถูกปลดปล่อยออกมาเมื่อถูกเผาไหม้ในลักษณะที่คล้ายกับที่ใช้ในเครื่องยนต์สันดาปภายในแบบดั้งเดิม บนพื้นฐานของมัน ยังสร้างเซลล์เชื้อเพลิงซึ่งเกี่ยวข้องกับการก่อตัวของน้ำและไฟฟ้าผ่านปฏิกิริยาเคมีของไฮโดรเจนกับออกซิเจน อาจเป็นอันตรายต่อมนุษย์เพราะสามารถติดไฟได้เมื่อสัมผัสกับอากาศ นอกจากนี้ก๊าซนี้ไม่เหมาะสำหรับการหายใจ
ไฮโดรเจนถูกใช้ในวิชาการบินตั้งแต่ปี ค.ศ. 1852 นับตั้งแต่เรือเหาะที่ใช้พลังงานไฮโดรเจนลำแรกถูกสร้างขึ้นโดย Henry Giffard เรือบินไฮโดรเจนถูกเรียกว่า "เซพพลิน" ในภายหลัง การใช้งานของพวกเขาถูกยกเลิกหลังจากการชนของเรือเหาะ Hindenburg ในปี 1937 อุบัติเหตุเกิดจากไฟไหม้
ไฮโดรเจนยังใช้กันอย่างแพร่หลายในอุตสาหกรรมน้ำมันและเคมี และมักใช้สำหรับงานทางกายภาพและวิศวกรรมต่างๆ เช่น ในงานเชื่อมและเป็นสารหล่อเย็น สูตรโมเลกุลของไฮโดรเจนเปอร์ออกไซด์ H2O2 สารนี้มักใช้ในการฟอกสีผมและเป็นสารทำความสะอาด ในรูปของยารักษาโรค มันยังใช้รักษาบาดแผลอีกด้วย
เนื่องจากไฮโดรเจนเบากว่าอากาศถึง 14 เท่า หากคุณเติมด้วย ลูกโป่งพวกเขาจะเคลื่อนตัวออกจากโลกด้วยความเร็ว 85 กม. ต่อชั่วโมง ซึ่งเป็นความเร็วสองเท่าของบอลลูนที่เติมฮีเลียม และความเร็วของบอลลูนที่เติมก๊าซธรรมชาติถึงหกเท่า
ก๊าซไฮโดรเจนเปอร์ออกไซด์เคมี
รายการใช้แล้ววรรณกรรม
1.http://www.5.km.ru/
2. http://hi-news.ru/science/ximiya-14-faktov-o-vodorode.html
โฮสต์บน Allbest.ru
...เอกสารที่คล้ายกัน
นักธรรมชาติวิทยา นักฟิสิกส์ และนักเคมีชาวอังกฤษ Henry Cavendish เป็นผู้ค้นพบไฮโดรเจน ทางกายภาพและ คุณสมบัติทางเคมีองค์ประกอบเนื้อหาโดยธรรมชาติ วิธีการหลักในการได้มาและขอบเขตการใช้ไฮโดรเจน กลไกการออกฤทธิ์ของระเบิดไฮโดรเจน
การนำเสนอเพิ่มเมื่อ 09/17/2012
ไอโซโทปของไฮโดรเจนเป็นอะตอมของธาตุไฮโดรเจนที่มีธาตุเคมีต่างกัน โดยมีนิวตรอนในนิวเคลียสแตกต่างกัน ซึ่งเป็นลักษณะทั่วไป สาระสำคัญของแนวคิดเรื่อง "น้ำเบา" ทำความคุ้นเคยกับข้อดีหลักของ protium water การวิเคราะห์วิธีการรับ
ภาคเรียนที่เพิ่ม 05/31/2013
คุณสมบัติของน้ำเป็นสารประกอบทางเคมีที่พบบ่อยที่สุด โครงสร้างโมเลกุลของน้ำและอะตอมไฮโดรเจน วิเคราะห์การเปลี่ยนแปลงคุณสมบัติของน้ำภายใต้อิทธิพลของปัจจัยต่างๆ แผนภาพแสดงแบบจำลองโมเลกุลของไฮดรอกซิล ไฮโดรเนียมไอออน และไฮโดรเจนเปอร์ออกไซด์
บทคัดย่อ เพิ่มเมื่อ 10/06/2010
ตำแหน่งของไฮโดรเจนในระบบธาตุเคมีเป็นระยะและคุณสมบัติของโครงสร้างของอะตอม คุณสมบัติของแก๊ส ความชุกและการเกิดขึ้นตามธรรมชาติ ปฏิกิริยาเคมีในการผลิตไฮโดรเจนในอุตสาหกรรมและในห้องปฏิบัติการและวิธีการใช้งาน
การนำเสนอ, เพิ่ม 02/13/2011
การกำหนดลักษณะคุณสมบัติทางเคมีและทางกายภาพของไฮโดรเจน ความแตกต่างของมวลอะตอมในไอโซโทปไฮโดรเจน โครงร่างของชั้นอิเล็กตรอนเดี่ยวของอะตอมไฮโดรเจนที่เป็นกลางซึ่งไม่ถูกกระตุ้น ประวัติการค้นพบ การค้นพบในธรรมชาติ วิธีการได้มา
การนำเสนอ, เพิ่ม 01/14/2011
การพิสูจน์วิธีเคมีไฟฟ้าในการได้มาซึ่งไฮโดรเจนและออกซิเจนด้วยกระแสไฟฟ้าของน้ำ ลักษณะของโครงการเทคโนโลยี การเลือกใช้อิเล็กโทรไลเซอร์ การเตรียมวัตถุดิบ (น้ำบริสุทธิ์) และการแปรรูปขั้นต้นที่เกิดจากอิเล็กโทรไลซิสของไฮโดรเจนและออกซิเจน
ภาคเรียนที่เพิ่ม 12/12/2011
วิธีการทางกายภาพของการสกัดไฮโดรเจนที่ใช้ในปัจจุบัน การผลิตไฮโดรเจนโดยอิเล็กโทรไลซิสของน้ำ ในกระบวนการแปรรูปถ่านหินและโค้ก วิธีความร้อนและความร้อน โฟโตไลซิส คุณสมบัติของการใช้อุปกรณ์และวัสดุในกระบวนการเหล่านี้
บทคัดย่อ เพิ่มเมื่อ 04/22/2012
ลักษณะขององค์กร OJSC "Gazprom neftekhim Salavat" ลักษณะของวัตถุดิบ ผลิตภัณฑ์ของกระบวนการ และรีเอเจนต์พื้นฐานของพืช "โมโนเมอร์" กระบวนการรับไฮโดรเจนทางเทคนิคและก๊าซสังเคราะห์ ลักษณะทั่วไปของการติดตั้ง ขั้นตอนและเคมีของกระบวนการ
ภาคเรียนที่เพิ่ม 03/03/2015
คุณสมบัติทางกายภาพของไฮโดรเจนเปอร์ออกไซด์ - ของเหลวใสไม่มีสีมีกลิ่นแปลก ๆ เล็กน้อย การรับสารในห้องปฏิบัติการและสภาพอุตสาหกรรม คุณสมบัติการลดและออกซิไดซ์ของไฮโดรเจนเปอร์ออกไซด์ซึ่งเป็นคุณสมบัติในการฆ่าเชื้อแบคทีเรีย
การนำเสนอ, เพิ่มเมื่อ 09/23/2014
ความหมายและตำแหน่งของไฮโดรเจนในองค์ประกอบของดวงอาทิตย์ บทบาทในระดับพลังงานที่โลกปล่อยออกมา คุณค่าขององค์ประกอบนี้ในชีวิตมนุษย์ การค้นหาแอนะล็อก คุณสมบัติทางเคมีและทางกายภาพ ความเป็นไปได้ของการใช้ไฮโดรเจนเป็นแหล่งพลังงานแห่งอนาคต



