เป็นก๊าซซึ่งมีความสำคัญในการดำรงอยู่ของสิ่งมีชีวิตบนโลกเมื่อหลายพันล้านปีก่อน ตามการคาดเดาในปัจจุบัน ไฮโดรเจน (H2) ปรากฏขึ้นเมื่อประมาณ 14 พันล้านปีก่อน ไม่มีสีหรือกลิ่น และเป็นธาตุที่เบาที่สุดในตารางธาตุเคมี โดยมีมวลอะตอมอยู่ที่ 1.00794 ไฮโดรเจนมีโครงสร้างผลึกหกเหลี่ยมและที่อุณหภูมิ 0 องศาเซลเซียสมีความหนาแน่น 0.09099 กรัม/ลิตร
ถือได้ว่าเป็นก๊าซ "ชนชั้นสูง" เนื่องจากมันถูกค้นพบในปี พ.ศ. 2309 โดยนักปรัชญาชาวอังกฤษ นักฟิสิกส์ และนักเคมีที่มีเกียรติอย่าง Henry Cavendish และได้รับชื่อในปี พ.ศ. 2326 ต้องขอบคุณนักฟิสิกส์ชาวฝรั่งเศส อองตวน ลาวัวซิเยร์ . ลอร์ดคาเวนดิชชอบเรียกการค้นพบของเขาว่า "อากาศที่ติดไฟได้" ลอร์ดคาเวดิชผู้มั่งคั่งอย่างน่าอัศจรรย์ขี้อายและถอนตัวออกไปจนหนึ่งในที่ดินของเขามีบันไดแยกไปที่ทางเข้าเนื่องจากเขาไม่สามารถสื่อสารกับคนรับใช้โดยเฉพาะผู้หญิงซึ่งเขาขี้อายเป็นพิเศษและสื่อสารผ่านโน้ตเท่านั้น ตามสมมติฐานสมัยใหม่ Henry Cavendish ได้รับความทุกข์ทรมานจากโรค Asperger's
สำหรับ Antoine Lavoisier จุดจบของเขาน่าเศร้า: หลังจากงานทางวิทยาศาสตร์ที่สำคัญทั้งหมดเขาถูกชาวนาฝรั่งเศสกีดกันศีรษะของเขาด้วยความช่วยเหลือของกิโยตินระหว่างการปฏิวัติฝรั่งเศส ไม่กี่สัปดาห์หลังจากเหตุการณ์ที่เกิดขึ้น พวกเขายอมรับความผิดพลาดและขอโทษครอบครัวของ Antoine Lavoisier และต่อมาก็สร้างรูปปั้นเพื่อเป็นเกียรติแก่เขา แต่เนื่องจากขาดเงินทุน หัวหน้าของสุภาพบุรุษอีกคนหนึ่งจึงติดอยู่กับรูปปั้นลาวัวซิเยร์ มันดูค่อนข้างแดกดันใช่มั้ย?
การปรับตัวนั้นยอดเยี่ยมมาก ไฮโดรเจนสามารถผลิตกระแสไฟฟ้าได้ ซึ่งเป็นสาเหตุที่ทำให้ใช้ในเซลล์เชื้อเพลิงและเป็นตัวเลือกที่สะอาดที่สุดในเครื่องยนต์สันดาปภายใน
ไฮโดรเจนเกิดขึ้นจากการระเบิดของบิ๊กแบง และตั้งแต่นั้นมา ก็มีการดำเนินงานในทรงกลมต่างๆ บนโลก ในช่วงสามและครึ่งพันล้านปีที่ผ่านมา บริษัทได้มีส่วนร่วมอย่างแข็งขันในการผลิตน้ำ ตลอดจนการกำเนิดและการบำรุงรักษาชีวิตเซลล์
ทุกวันนี้ ไฮโดรเจน (H2) อยู่ภายใต้การพิจารณาอย่างถี่ถ้วนในการวิจัยทางการแพทย์ การศึกษาทางวิทยาศาสตร์หลายร้อยชิ้นได้พิสูจน์ศักยภาพการรักษาของน้ำที่อุดมด้วยไฮโดรเจนสำหรับแบบจำลองโรคต่างๆ มากกว่า 140 แบบ
ต่อไปนี้คือภาพรวมโดยย่อของความเป็นไปได้ในการรักษาบางอย่างของไฮโดรเจนและน้ำไฮโดรเจน:
- ลดแรงตึงผิวของเซลล์ ทำให้เซลล์ดูดซับสารอาหารได้ดีขึ้น
- นี่เป็นตัวที่เล็กที่สุดที่มีการดูดซึมสูง
- ไฮโดรเจนจะกำจัดเฉพาะสารที่ทำลายล้างมากที่สุดเท่านั้น และเปลี่ยนเป็นน้ำที่ปลอดภัยโดยไม่มีของเสียที่เป็นพิษ
- เสริมการทำงานของสารต้านอนุมูลอิสระ เช่น กลูตาไธโอน และซูเปอร์ออกไซด์ ดิสมิวเตส
- ช่วยในการใช้ความชุ่มชื้นที่เหมาะสมของเซลล์
- น้ำไฮโดรเจนช่วยลดกรดแลคติกและบรรเทาอาการปวดกล้ามเนื้อระหว่างและหลังการออกกำลังกาย
- ส่งเสริมการผลิต ATP ในไมโตคอนเดรีย
- น้ำไฮโดรเจนช่วยเพิ่มการทำงานของไมโตคอนเดรียในสมอง ซึ่งจะช่วยปรับปรุงการทำงานของสมอง ยังรักษาสมดุลของน้ำตาลและคอเลสเตอรอล
- น้ำไฮโดรเจนมีฤทธิ์ต้านการอักเสบและป้องกันอันตรายจากรังสี ดังนั้นการใช้งานจึงถูกกำหนดโดยนักบินอวกาศในระหว่างเที่ยวบิน
- มีฤทธิ์ต้านการแพ้
อ่านบทความ
ตั้งแต่สมัยโบราณ ผู้คนรู้จักสารที่สามารถละลายโลหะบางชนิดได้ สารละลายที่อ่อนแอของสารเหล่านี้มีรสเปรี้ยวจึงเรียกว่า "กรด" ตัวอย่างเช่น กรดซิตริกพบได้ในมะนาว กรดมาลิกในแอปเปิ้ล สารที่มีสูตรทางเคมี H 2 SO 4 เรียกว่า กรดซัลฟิวริก
นักวิจัยหลายคนได้ทดลองกับกรด สังเกตได้ว่าเมื่อกรดทำปฏิกิริยากับโลหะบางชนิด จะเกิดฟองแก๊สออกมา ก๊าซที่ได้นั้นติดไฟได้สูงและถูกเรียกว่า "อากาศที่ติดไฟได้"
คุณสมบัติของก๊าซนี้ได้รับการศึกษาโดยละเอียดโดยนักวิทยาศาสตร์ชาวอังกฤษ G. Cavendish ในปี ค.ศ. 1766 เขาวางโลหะลงในสารละลายของกรดซัลฟิวริกและกรดไฮโดรคลอริก และในทุกกรณีก็ได้รับสารก๊าซเบาชนิดเดียวกัน ซึ่งต่อมาเรียกว่าไฮโดรเจน
ให้เรายกตัวอย่างสมการของปฏิกิริยาของปฏิกิริยาของโลหะกับกรดในระหว่างที่เกิดไฮโดรเจน เมื่อเหล็กทำปฏิกิริยากับ กรดไฮโดรคลอริกเกิดเป็นเหล็ก (II) คลอไรด์และไฮโดรเจน เมื่อเหล็กทำปฏิกิริยากับสารละลายของกรดซัลฟิวริก จะเกิดเหล็กซัลเฟต (II) FeSO 4 และไฮโดรเจนขึ้น โปรดทราบว่าในปฏิกิริยาทั้งสอง ไฮโดรเจนจะถูกปล่อยออกจากสารละลายตามที่ระบุโดยลูกศร
ข้าว. 1. ปฏิกิริยาของเหล็กกับกรดไฮโดรคลอริก

ข้าว. 2. ปฏิกิริยาของเหล็กกับสารละลายกรดซัลฟิวริก
ปฏิกิริยาข้างต้นเป็นของประเภทการทดแทน ในแต่ละปฏิกิริยาเหล่านี้ สารธรรมดาหนึ่งชนิดและสารเชิงซ้อนหนึ่งชนิดจะป้อน และเกิดสารเชิงซ้อนและสารเชิงซ้อนใหม่ขึ้น ปฏิกิริยาดังกล่าวเรียกว่าปฏิกิริยาการแทนที่
โลหะบางชนิดสามารถแทนที่ไฮโดรเจนในกรดได้
ดังนั้นกรดจึงเป็นสารที่มีไฮโดรเจนซึ่งสามารถแทนที่ด้วยโลหะได้
ชื่อ "ไฮโดรเจน" มาจากภาษากรีก คำว่า "gidor" - น้ำและ "genao" - ฉันให้กำเนิดเช่น "ให้กำเนิดน้ำ" แท้จริงแล้ว เมื่อไฮโดรเจนถูกเผาไหม้ น้ำก็ก่อตัวขึ้น ชื่อนี้ได้รับการแนะนำโดย A. Lavoisier ในปี ค.ศ. 1779
ไฮโดรเจนเป็นองค์ประกอบทางเคมีที่มีมากที่สุดในจักรวาลและเป็นองค์ประกอบหลักของดาวฤกษ์ ไฮโดรเจนองค์ประกอบทางเคมีเป็นส่วนหนึ่งของพืชและสัตว์ทั้งหมด รวมทั้งองค์ประกอบของสารที่พบบ่อยที่สุดบนโลก - น้ำ
ไฮโดรเจนสารอย่างง่ายมีสูตร H2 . เป็นสารที่เป็นก๊าซ ไม่มีรส ไม่มีกลิ่น ละลายได้เล็กน้อยในน้ำ จุดเดือดของไฮโดรเจนคือ -253°C ไฮโดรเจนเป็นก๊าซที่เบาที่สุดในบรรดาสารที่เป็นก๊าซ โดยเบากว่าอากาศ 14.5 เท่า
2. รับไฮโดรเจนและตรวจสอบความบริสุทธิ์ ()
การบ้าน
1) กับ. 76-78 №№ 2,3,5,6,9จากหนังสือวิชาเคมี ป.8 สู่ตำรา ป.อ. Orzhekovsky และอื่น ๆ “ เคมี เกรด 8” / O.V. Ushakova, P.I. Bespalov, P.A. ออร์เจคอฟสกี; ภายใต้. เอ็ด ศ. ป. Orzhekovsky - M .: AST: Astrel: Profizdat, 2006
2) หน้า 140-141 หมายเลข 2,6จากตำราป. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova "เคมี: เกรด 8", 2013
ประวัติความเป็นมาของการค้นพบไฮโดรเจนถือเป็นก้าวสำคัญในการพัฒนาวิทยาศาสตร์ ตามแนวคิดทางวิทยาศาสตร์สมัยใหม่ ก๊าซนี้เป็นหนึ่งในสารที่สำคัญที่สุดสำหรับการดำรงอยู่ของดาวฤกษ์ และด้วยเหตุนี้จึงเป็นแหล่งพลังงานหลัก
ประวัติโดยย่อของการค้นพบไฮโดรเจน
องค์ประกอบนี้ถูกค้นพบโดยนักวิทยาศาสตร์ชาวอังกฤษในปี พ.ศ. 2309 ที่มาของชื่อนี้ย้อนกลับไปที่คำภาษากรีก "ไฮโดร" และ "ยีน" ซึ่งหมายถึง "น้ำ" และ "เครื่องกำเนิด"
เร็วเท่าที่ 1671 โรเบิร์ต บอยล์ (1627-1691 นักเคมีและนักฟิสิกส์ชาวอังกฤษ) ตีพิมพ์ "การทดลองใหม่เกี่ยวกับความสัมพันธ์ระหว่างเปลวไฟกับอากาศ" ซึ่งเขาอธิบายปฏิกิริยาระหว่างตะไบเหล็กและกรดเจือจาง ในระหว่างการทดลอง นักวิทยาศาสตร์สังเกตว่าปฏิกิริยาของสารเหล่านี้นำไปสู่การวิวัฒนาการของก๊าซไฮโดรเจน ("สารละลายที่ติดไฟได้ของดาวอังคาร")
อย่างไรก็ตาม จนกระทั่งปี 1766 แก๊สได้รับการอนุมัติให้เป็นองค์ประกอบหลักโดย Henry Cavendish (1731-1810 นักเคมีและนักฟิสิกส์ชาวอังกฤษที่ค้นพบไนโตรเจนด้วย) ซึ่งใช้ปรอทในการสังเคราะห์ นักวิทยาศาสตร์อธิบายว่ามันเป็น "อากาศที่ติดไฟได้ของโลหะ" คาเวนดิชอธิบายคุณสมบัติของไฮโดรเจนได้อย่างแม่นยำ แต่เชื่ออย่างผิด ๆ ว่าก๊าซนั้นมาจากโลหะและไม่ได้มาจากกรด ชื่อสมัยใหม่สำหรับองค์ประกอบทางเคมีถูกกำหนดโดย A. L. Lavoisier นักธรรมชาติวิทยาชาวฝรั่งเศส
ประวัติการค้นพบไฮโดรเจน (H) ไม่ได้จบเพียงแค่นั้น ในปี 1931 ศาสตราจารย์ด้านเคมี Harold Urey ซึ่งทำงานในชิคาโก (สหรัฐอเมริกา) ได้ค้นพบก๊าซดิวเทอเรียม เป็นไอโซโทปหนักของไฮโดรเจนและเขียนเป็น 2 H และ D

รากฐานของจักรวาล
เป็นเวลานานผู้คนไม่เข้าใจคุณสมบัติของสสาร แม้ว่าชาวกรีกโบราณสันนิษฐานว่า "อีเธอร์" (พื้นที่โดยรอบ) ประกอบด้วยองค์ประกอบบางอย่าง แต่ก็ไม่มีเหตุผลที่ชัดเจนและยิ่งมีหลักฐานที่ชัดเจนสำหรับข้อเท็จจริงนี้
ในฤดูใบไม้ร่วงปี 1803 ชาวอังกฤษสามารถอธิบายผลการวิจัยบางส่วนของเขาได้โดยสมมติว่าสสารนั้นประกอบด้วยอะตอม นักวิจัยยังพบว่าตัวอย่างทั้งหมดของสารประกอบที่กำหนดประกอบด้วยอะตอมเหล่านี้รวมกันเหมือนกัน ดาลตันยังตั้งข้อสังเกตอีกว่าในสารประกอบจำนวนหนึ่ง อัตราส่วนของมวลของธาตุที่สอง ซึ่งรวมกับน้ำหนักที่กำหนดขององค์ประกอบแรก สามารถลดลงเป็นจำนวนเต็มขนาดเล็กได้ ("กฎของสัดส่วนหลายส่วน") ดังนั้นนักวิทยาศาสตร์จึงมีความสัมพันธ์บางอย่างกับประวัติการค้นพบไฮโดรเจน
การนำเสนอ "ทฤษฎีอะตอม" ของดาลตันเกิดขึ้นในเล่มที่ 3 ของ "Systems of Chemistry" ฉบับทางวิทยาศาสตร์ซึ่งจัดพิมพ์โดยโธมัส ธอมสันในปี พ.ศ. 2350 เนื้อหานี้ยังปรากฏในบทความเกี่ยวกับสตรอนเทียมออกซาเลตที่ตีพิมพ์ในธุรกรรมทางปรัชญา ที่ ปีหน้าดัลตันได้ตีพิมพ์แนวคิดเหล่านี้ด้วยตัวเขาเอง เพื่อทำการวิเคราะห์อย่างละเอียดยิ่งขึ้นใน The New System of Chemical Philosophy โดยวิธีการที่นักวิทยาศาสตร์แนะนำให้ใช้วงกลมที่มีจุดตรงกลางเป็นสัญลักษณ์ของไฮโดรเจน
เซลล์เชื้อเพลิงแรก
ประวัติการค้นพบไฮโดรเจนมีเหตุการณ์ที่น่าสนใจมากมาย ในปี พ.ศ. 2382 นักวิทยาศาสตร์ชาวอังกฤษ เซอร์ วิลเลียม โรเบิร์ต โกรฟ ได้ทำการทดลองเกี่ยวกับกระแสไฟฟ้า เขาใช้ไฟฟ้าแยกน้ำออกเป็นไฮโดรเจนและออกซิเจน ต่อมาผู้วิจัยสงสัยว่าเป็นไปได้ไหมที่จะทำตรงกันข้าม - เพื่อผลิตไฟฟ้าจากปฏิกิริยาของออกซิเจนกับไฮโดรเจน? โกรฟปิดผนึกบันทึกแพลตตินั่มในภาชนะที่ปิดสนิทแยกกัน ภาชนะหนึ่งบรรจุไฮโดรเจนและออกซิเจนอื่น เมื่อแช่ภาชนะในกรดซัลฟิวริกเจือจาง กระแสไฟฟ้าจะไหลระหว่างอิเล็กโทรดทั้งสอง ทำให้เกิดน้ำในถังแก๊ส จากนั้นนักวิทยาศาสตร์ได้เชื่อมต่ออุปกรณ์ที่คล้ายกันหลายตัวในวงจรอนุกรมเพื่อเพิ่มแรงดันไฟฟ้าที่สร้างขึ้นในแบตเตอรี่แก๊ส
นับแต่นั้นเป็นต้นมา ไฮโดรเจนได้ตั้งความหวังไว้มากในแง่ของการได้มาซึ่งแหล่งพลังงานขนาดกะทัดรัดและเป็นมิตรกับสิ่งแวดล้อม อย่างไรก็ตาม ปัญหาด้านความปลอดภัย 100% และประสิทธิภาพสูงของอุปกรณ์ปลายทางสำหรับการบริโภคจำนวนมากยังไม่ได้รับการแก้ไข อย่างไรก็ตาม คำว่า "เซลล์เชื้อเพลิง" ถูกใช้ครั้งแรกโดยนักเคมี Ludwig Mond และ Charles Langer ซึ่งยังคงทำการวิจัยของ W. R. Grove ต่อไป
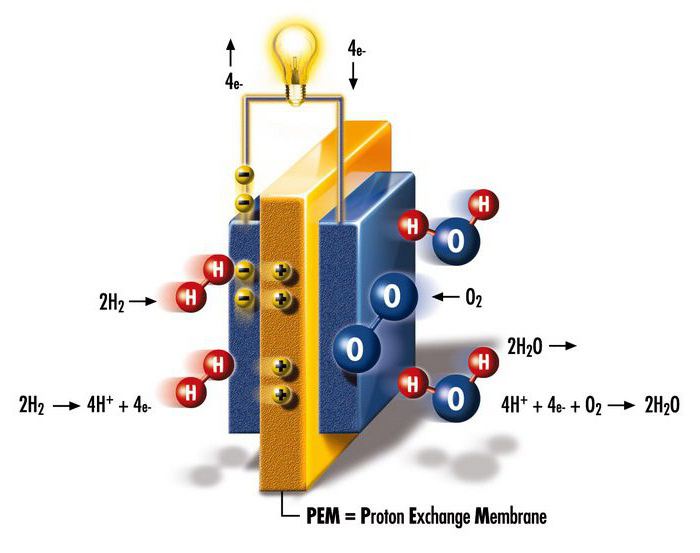
แหล่งพลังงานอิสระ
ในปี ค.ศ. 1932 ฟรานซิส โธมัส เบคอน วิศวกรจากมหาวิทยาลัยเคมบริดจ์ในสหราชอาณาจักร ยังคงทำงานเกี่ยวกับการออกแบบของ Grove, Mond และ Langer เขาเปลี่ยนอิเล็กโทรดแพลตตินัมด้วยตาข่ายนิกเกิลที่มีราคาไม่แพง และแทนที่จะใช้อิเล็กโทรไลต์ที่มีกรดซัลฟิวริก เขาใช้โพแทสเซียมไฮดรอกไซด์อัลคาไลน์ (กัดกร่อนอิเล็กโทรดน้อยกว่า) โดยพื้นฐานแล้วนี่คือการสร้างเซลล์เชื้อเพลิงอัลคาไลน์ตัวแรกที่เรียกว่าเซลล์เบคอน อังกฤษใช้เวลาอีก 27 ปีในการสาธิตโรงงานที่สามารถผลิตพลังงานได้ 5 กิโลวัตต์ ซึ่งเพียงพอสำหรับให้พลังงานแก่เครื่องเชื่อม ในช่วงเวลาเดียวกัน มีการสาธิตรถยนต์เซลล์เชื้อเพลิงคันแรก
ต่อมานาซ่าใช้เซลล์เชื้อเพลิงในทศวรรษ 1960 สำหรับโครงการ Apollo lunar เซลล์ของเบคอนอยู่บนยานอวกาศหลายร้อยลำ นอกจากนี้ยังใช้ "แบตเตอรี่ขนาดใหญ่" ในเรือดำน้ำ

มีประโยชน์แต่อันตราย
ประวัติความเป็นมาของการค้นพบไฮโดรเจนไม่เพียงเกี่ยวข้องกับช่วงเวลาที่สนุกสนานเท่านั้น โศกนาฏกรรมของเรือเหาะยักษ์ Hindenburg เป็นพยานว่าองค์ประกอบนี้ไม่ปลอดภัยเพียงใด ในช่วงทศวรรษที่ 1930 เยอรมนีได้สร้างเครื่องบินหลายลำ - เรือเหาะ ไฮโดรเจนถูกใช้เป็นก๊าซ ด้วยน้ำหนักที่เบากว่าส่วนผสมของไนโตรเจน-ออกซิเจนที่ประกอบขึ้นเป็นส่วนใหญ่ของบรรยากาศ ทำให้สามารถขนส่งสินค้าปริมาณมากได้
ในปี 1936 นักออกแบบชาวเยอรมันได้นำเสนอเรือเหาะที่ใหญ่ที่สุดในโลกในเวลานั้นคือ Hindenburg ยักษ์สูง 245 เมตรบรรจุก๊าซ 200,000 ลูกบาศก์เมตร ความสามารถในการบรรทุกของมันน่าทึ่งมาก: อุปกรณ์สามารถยกสินค้าได้มากถึง 100 ตันขึ้นไปบนท้องฟ้า เครื่องบินลำนี้ใช้สำหรับการขนส่งข้ามมหาสมุทรแอตแลนติกระหว่างเยอรมนีและสหรัฐอเมริกา เรือกอนโดลาผู้โดยสารสามารถรองรับผู้โดยสารได้ 50 คนพร้อมกระเป๋าเดินทาง 05/06/1937 เมื่อมาถึงนิวยอร์ก เกิดการรั่วไหลของไฮโดรเจน ก๊าซไวไฟติดไฟทำให้เกิดการระเบิดที่ทำให้มีผู้เสียชีวิต 36 ราย ตั้งแต่นั้นมา ฮีเลียมที่ปลอดภัยกว่าได้ถูกใช้แทนไฮโดรเจนในเครื่องบิน
บทสรุป
ไฮโดรเจนเป็นหนึ่งใน องค์ประกอบที่สำคัญในจักรวาล แม้ว่าคุณสมบัติต่างๆ จะได้รับการศึกษามาเป็นอย่างดี แต่ก็ยังไม่เลิกสนใจนักวิทยาศาสตร์ วิศวกร และนักออกแบบ องค์ประกอบนี้เป็นหัวข้อของเอกสารทางวิทยาศาสตร์ อนุปริญญา และบทคัดย่อนับพัน ประวัติความเป็นมาของการค้นพบไฮโดรเจนเป็นประวัติศาสตร์ของวิทยาศาสตร์เอง ซึ่งเป็นระบบของความรู้ที่มาแทนที่ความไม่รู้และหลักคำสอนทางศาสนา
1ประวัติความเป็นมาของการค้นพบไฮโดรเจน คุณสมบัติทางกายภาพและทางเคมี. วิธีการผลิตไฮโดรเจน
ภาษิต บทเรียน:
การจะเป็นนักเคมีตัวจริง คุณต้องรู้ คิดได้!”

Epigraph ของบทเรียน:
“สำหรับคนที่รู้น้อย
และนี่คือมาก
และสำหรับใครที่อยากทราบมากๆ
และนั่นยังไม่พอ"


คำถาม:
เกี่ยวกับการค้นพบก๊าซที่เป็นปัญหา
ใครเป็นผู้ค้นพบก๊าซนี้?
คุณสมบัติทางกายภาพของ O2 ใดที่กล่าวถึงในบทกวี
สารใดที่เกิดขึ้นระหว่างการเกิดออกซิเดชัน (ออกไซด์)
ออกไซด์คืออะไร?
ออกไซด์ใดถูกใช้เพื่อค้นหาออกซิเจน

ออกกำลังกาย:
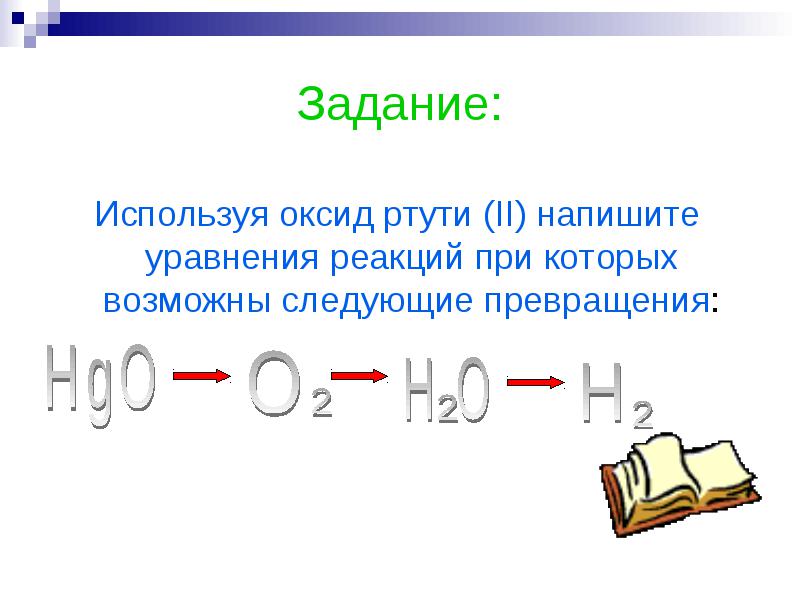
ใช้ปรอท (II) ออกไซด์ เขียนสมการปฏิกิริยาที่เป็นไปได้ในการแปลงต่อไปนี้:
ตรวจสอบตัวเอง:
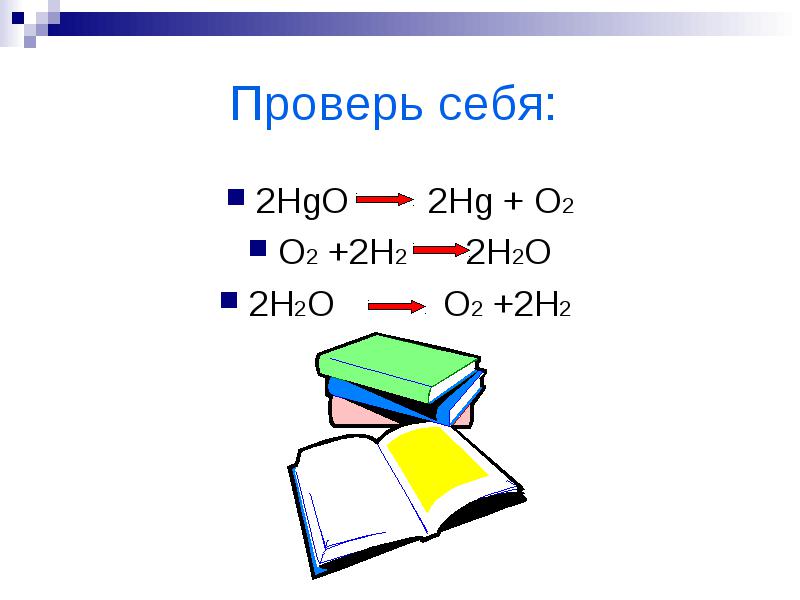
2HgO 2Hg + O2
O2 +2H2 2H2O
2H2O O2 +2H2
.
เป้า:
ทำความรู้จักกับการกระจายไฮโดรเจนในธรรมชาติ
เรียนรู้เกี่ยวกับประวัติการค้นพบไฮโดรเจน
เพื่อศึกษาคุณสมบัติทางกายภาพและเคมีของไฮโดรเจนเปรียบเทียบกับออกซิเจน
พิจารณาการใช้งานหลักของไฮโดรเจน


เปลือกโลก
(เศษส่วนมวล)



การแพร่กระจายบนโลก
น้ำ - H2O
มีเทน - CH4 ไฮโดรเจนซัลไฟด์ -
การแพร่กระจายในจักรวาล
ไฮโดรเจนเป็นธาตุที่มีมากที่สุดในจักรวาล
คิดเป็นประมาณ 92% ของอะตอมทั้งหมด
(8% เป็นอะตอมฮีเลียม ส่วนแบ่งขององค์ประกอบอื่น ๆ ที่นำมารวมกันน้อยกว่า 0.1%)
ไฮโดรเจนเป็นองค์ประกอบหลักของดาวฤกษ์และก๊าซระหว่างดวงดาว
ที่อุณหภูมิดาวฤกษ์ ไฮโดรเจนมีอยู่ในรูปของพลาสมา
ในอวกาศระหว่างดวงดาว ธาตุนี้มีอยู่ในรูปของโมเลกุล อะตอม และไอออนแต่ละตัว
และสามารถสร้างเมฆโมเลกุลที่มีขนาด ความหนาแน่น และอุณหภูมิแตกต่างกันอย่างมาก

งาน 3 หน้า 76
สารประกอบใดมีไฮโดรเจนมากกว่า: H2O หรือ CH4
ทดสอบตัวเอง: วิธีแก้ปัญหา


ศตวรรษที่ 16 - Paracelsus และ R. Boyle อธิบาย H2 1700 - N. Lemery - แก๊สที่เกิดจากการกระทำของ H2SO4 บน Fe - ระเบิด 1766 G. Cavendish ค้นพบ H2 และเรียกมันว่า "อากาศที่ติดไฟได้" ในปี ค.ศ. 1781 A. Lavoisier ได้พิสูจน์ว่า H2O เป็นผลจากปฏิสัมพันธ์ของ H2 และ O2 (H2 - จากภาษากรีก "ให้กำเนิด H2O") พ.ศ. 2367 โซโลวีฟเสนอชื่อรัสเซียว่า "ไฮโดรเจน"
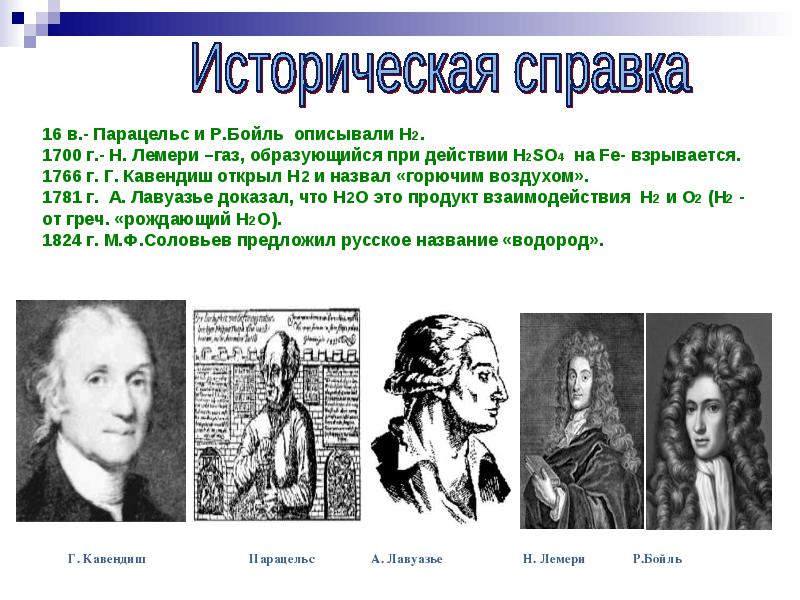
นักฟิสิกส์และนักเคมีชาวอังกฤษชื่อ G.Kavedish ศึกษาก๊าซนี้ในปี 1766 และเรียกมันว่า "อากาศที่ติดไฟได้" เมื่อถูกเผา "อากาศที่ติดไฟได้" จะผลิตน้ำ แต่การที่คาเวนดิชยึดมั่นในทฤษฎีโฟลจิสตันทำให้เขาไม่สามารถสรุปผลที่ถูกต้องได้

นักเคมีชาวฝรั่งเศส A. Lavoisier ร่วมกับวิศวกร J. Meunier โดยใช้เครื่องวัดก๊าซแบบพิเศษในปี 1783 ได้ทำการสังเคราะห์น้ำ และจากนั้นทำการวิเคราะห์ สลายไอน้ำด้วยเหล็กร้อนแดง ดังนั้น เขาจึงกำหนดว่า "อากาศที่ติดไฟได้" เป็นส่วนหนึ่งของน้ำและสามารถหาได้จากมัน ในปี ค.ศ. 1787 ลาวัวซิเยร์ได้ข้อสรุปว่า "อากาศที่ติดไฟได้" เป็นสารธรรมดาและดังนั้นจึงเป็นหนึ่งในองค์ประกอบทางเคมี เขาตั้งชื่อมันว่าไฮโดรเจน (จากภาษากรีก hydor - น้ำและ gennao - ให้กำเนิด) - "ให้กำเนิดน้ำ"
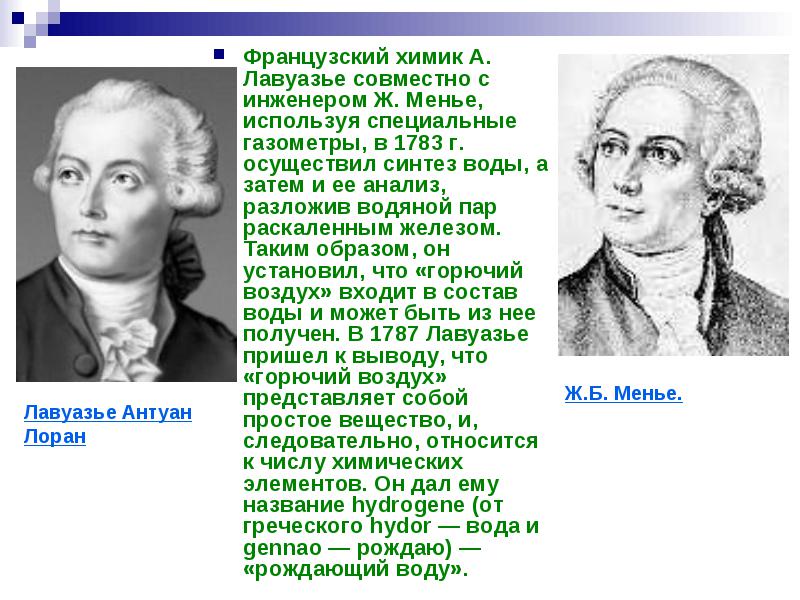
ศตวรรษก่อตั้งขึ้น
ชื่อรัสเซีย "ไฮโดรเจน" ถูกเสนอโดยนักเคมี M.F. Solovyov ในปี 1824 ในช่วงเปลี่ยนศตวรรษที่ 18 และ 19 พบว่าอะตอมไฮโดรเจนมีน้ำหนักเบามาก (เมื่อเทียบกับอะตอมของธาตุอื่นๆ) และนำน้ำหนัก (มวล) ของอะตอมไฮโดรเจนมาเป็นหน่วยเปรียบเทียบมวลอะตอม ขององค์ประกอบ มวลของอะตอมไฮโดรเจนมีค่าเท่ากับ 1

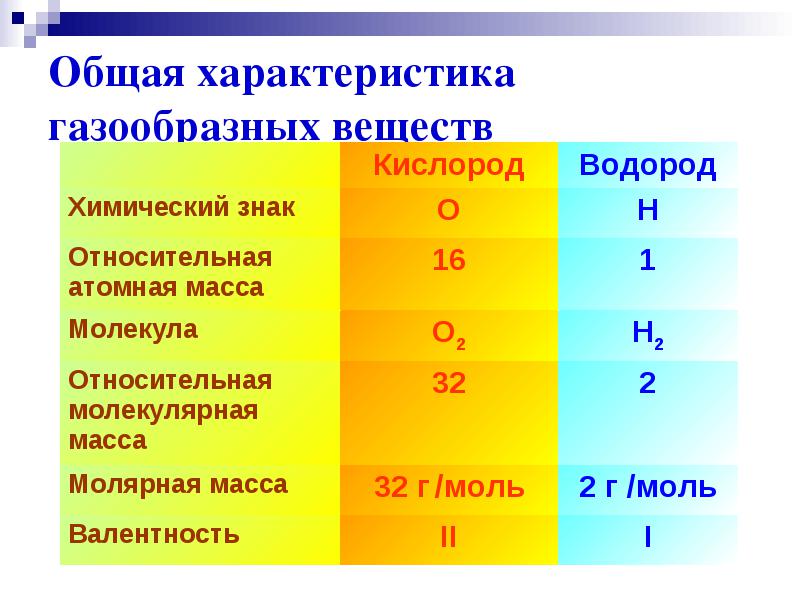
คุณสมบัติทางกายภาพของไฮโดรเจน
โมเลกุลไฮโดรเจนเป็นไดอะตอมมิก - H 2 .
ภายใต้สภาวะปกติ จะเป็นก๊าซไม่มีสี ไม่มีกลิ่น และรสจืด
ความหนาแน่น 0.08987 g/l (N.O.),
จุดเดือด −252.76 °C,
ละลายได้เล็กน้อยในน้ำ - 18.8 มล. / ลิตร
ม(H 2 )=2g/โมล
วาเลนซี


ลักษณะทั่วไปของสารที่เป็นก๊าซ
นาทีพลศึกษา

ปริศนา:
ก๊าซที่เบาที่สุดในโลก
และมันอยู่ในกาแล็กซี่
ในบอลลูนที่มีแก๊ส
คุณสามารถบินไปยังดวงดาว
_____________________________
เราไม่สามารถอยู่ได้โดยปราศจากมัน
เขาจะช่วยพวกเราทุกคนเสมอ
เขาอยู่ทุกที่ -
ทั้งบนบกและในน้ำ
ใครในพวกคุณจะบอกฉัน
ชื่อก๊าซนี้คืออะไร?
____________________________
ในวิหาร Mendeleev
ฉันอาศัยอยู่ชั้นบน
ในโถงทางเดินต่างๆ
ฉันมีอพาร์ทเมนท์สองห้อง
และเป็นที่หนึ่ง!
เป็นนายแบบที่ฉันเป็น!

เครื่องคิป


ปฏิกิริยาของสังกะสีกับกรดไฮโดรคลอริก



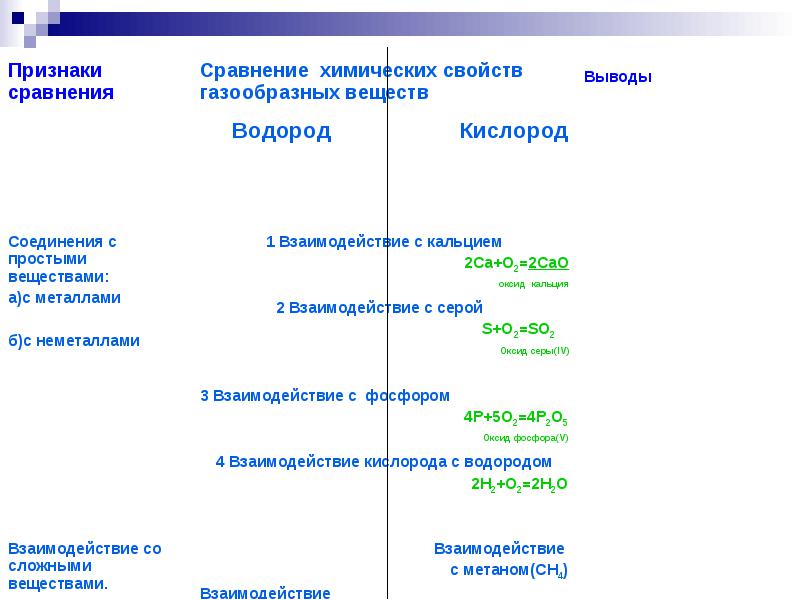

คุณสมบัติของการจัดการไฮโดรเจน
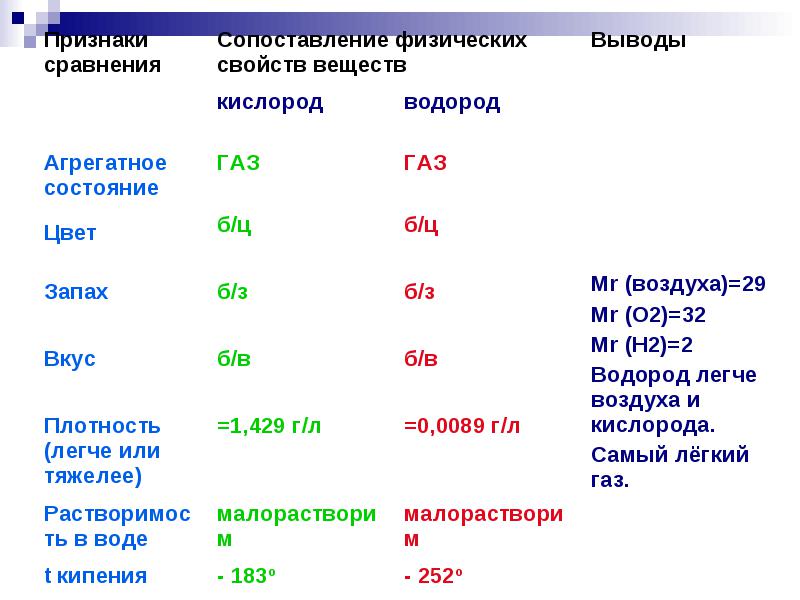
ไฮโดรเจนเมื่อผสมกับอากาศจะเกิดส่วนผสมที่ระเบิดได้ ซึ่งเรียกว่าแก๊สระเบิด
อันตรายจากการระเบิดสูงสุดที่อัตราส่วนปริมาตรของไฮโดรเจนและออกซิเจน 2: 1
หรือไฮโดรเจนกับอากาศประมาณ 2:5
ไฮโดรเจนยังติดไฟได้
ไฮโดรเจนเหลวอาจทำให้เกิดอาการบวมเป็นน้ำเหลืองอย่างรุนแรงหากสัมผัสกับผิวหนัง
ความเข้มข้นของไฮโดรเจนกับออกซิเจนที่ระเบิดได้เกิดขึ้นจาก 4% ถึง 96% โดยปริมาตร
เมื่อผสมกับอากาศตั้งแต่ 4% ถึง 75(74)% โดยปริมาตร

Andrei Dmitrievich Sakharov 21 พฤษภาคม 2464 - 14 ธันวาคม 2532

การเขียนตามคำบอกทางเคมี:
หมายเลข 8 บรรทัดในคอลัมน์ เขียนสูตรของก๊าซที่ต้องการถัดจากตัวเลขแต่ละตัว
1. แก๊สเบา
2. แก๊สหนัก
3. ก๊าซสนับสนุนการเผาไหม้
4. แก๊สเมื่อผสมกับออกซิเจนจะระเบิดภายใต้สภาวะปกติ
5. รวบรวมโดยการกระจัดของอากาศ
6. รวบรวมในเรือคว่ำ
7. การเก็บเกี่ยวโดยการกำจัดน้ำ
8. รวบรวมในภาชนะที่วางอยู่ด้านล่าง

คำตอบที่ถูกต้อง:
1) คะแนน H2:
2) O2 "5" -10-9 หลุม
3) O2. "4" - 8-7 หลุม
4) H2 "3" - 6-4 รู
5) H2, O2
6) H2.
7) O2, H2
8) O2.


ทดสอบ:
ทดสอบ:
1. เปรียบเทียบก๊าซและคุณสมบัติของพวกมัน:
ก) ไฮโดรเจน 1) มีส่วนร่วมในกระบวนการเผาไหม้และการหายใจเอง
B) ออกซิเจน 2) ก๊าซที่เบาที่สุดที่ทำปฏิกิริยากับออกซิเจน
เกิดเป็นน้ำ
_______________________________________________________
2. คุณสมบัติใดต่อไปนี้ของไฮโดรเจนที่มีทางกายภาพ:
ก) ก๊าซที่เบาที่สุด
B) ไม่มีกลิ่นและสี
B) เผาไหม้ด้วยเปลวไฟ
D) ละลายได้เล็กน้อยในน้ำ
____________________________________________________________
3. สมบัติทางการระเบิดมีส่วนผสมของ
ก) ออกซิเจนและไฮโดรเจน
B) ออกซิเจนและไนโตรเจน
B) คาร์บอนไดออกไซด์และออกซิเจน
ง) ไฮโดรเจนและคาร์บอนไดออกไซด์

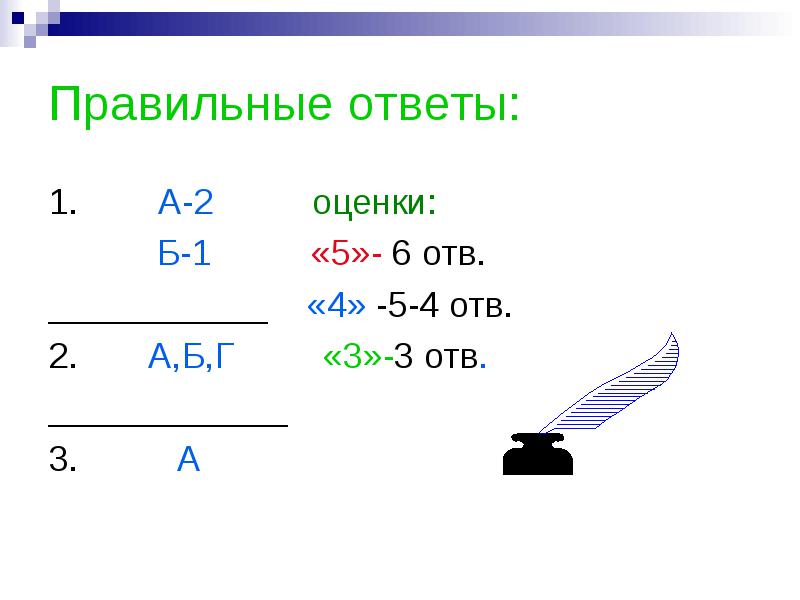
คำตอบที่ถูกต้อง:
1. เกรด A-2:
B-1 "5" - 6 รู
___________ "4" -5-4 รู
2. A, B, G "3" -3 รู
____________
งานเป็นเรื่องลึกลับ
การทดลองทั้งหมดถูกเลื่อนออกไป
การคำนวณถูกขัดจังหวะ
เช้าวันเดินทางไกล
นักวิทยาศาสตร์ไป
และทันใดนั้น…
หมวกถูกโยนเข้ามุม!
เขารีบไปที่โต๊ะ!
เขาเขียนอะไรก็ได้
ไม่ได้ยินอะไรรอบตัว
ป้องกันการระเบิดที่น่ากลัว"
นักวิทยาศาสตร์เขียนอะไรถึงเพื่อนร่วมงานของเขาในข้อความนี้

ภารกิจคือปริศนา
S S D O D A S K I S
M E V O R O D O R O L
CH A T A M O M I L I
V Y R Z V X U D Z O V

ตรวจสอบตัวเอง:
"ส่วนผสมของไฮโดรเจนและออกซิเจน
หรือระเบิดอากาศ


หน้า 25-27;
หน้า 25-27;
แบบฝึกหัด 5.9 หน้า 77
งานสร้างสรรค์ "ทำไมไฮโดรเจนถึงเรียกว่าเชื้อเพลิงแห่งอนาคต"
เขียนปริศนาเกี่ยวกับไฮโดรเจน






