تؤخذ مادة الفحص البكتريولوجي في طبق معقم من قبل
بدء العلاج بالمضادات الحيوية.
التسليم بالامتثال للمواعيد النهائية في بيكس دون انخفاض حرارة الجسم.
الدم
من أجل العقم (البكتيريا الدقيقة ، ثقافة الدم) ، يؤخذ معقمًا أثناء رفع درجة الحرارة إلى وسط مغذي "مزدوج" يتم تسخينه إلى 37 درجة مئوية بكمية 10 مل عند البالغين و 0.1-5 مل عند الأطفال (بنسبة 1:10 ). يتم أخذ عينات الدم من قبل شخصين: أحدهما يعالج الجلد ، ويثقب الوريد ويأخذ الدم في حقنة ، والثاني يفتح أغطية القوارير فوق لهب مصباح كحول ، ويستبدلها تحت تيار دم من حقنة ، يحرق عنق القوارير أو أنابيب الاختبار ، ويغلقها ويجانسها بحيث لا تكون هناك جلطات دموية. وفقًا للإشارات ، يتم إجراء مسحة في نفس الوقت على شريحة زجاجية. الولادة بدون انخفاض حرارة الجسم. يوصى بأخذ الدم في نفس الوقت في ثلاث قوارير. في المساء ، ليلاً ويوم الأحد ، ضع زجاجات الدم في منظم حرارة عند 37 درجة مئوية في المختبر السريري.
البول
يتم أخذ متوسط الكمية الصباحية (التراكمية) من البول بعد مرحاض الأعضاء التناسلية الخارجية إلى البكتيريا بحجم 3-5 مل. يتم التوصيل في موعد لا يتجاوز ساعتين إذا تم تخزينه في الثلاجة. مع التهاب الإحليل والتهاب المثانة - أخذ عينات من الجزء الأول من البول.
اللعاب
قبل أخذ العينات ، اغسل أسنانك بالفرشاة ، اشطف فمك بالماء المغلي أو بمحلول مطهر ، اجمع بصاق الصباح (التراكمي) بدون لعاب بكمية 1-5 مل. تسليم في موعد لا يتجاوز ساعتين من لحظة الجمع.
1. في حالة المرض - مع مسحة قطنية معقمة على حدة لكل أنف
بالطبع من الأقسام العميقة بعد تخليص الأنف من المخاط. عندما تجف
الغشاء المخاطي - مبلل بمحلول كلوريد الصوديوم بنسبة 0.9٪ باستخدام قطعة قطن.
2. لنقل المكورات العنقودية الذهبية - من الأجزاء الأمامية من تجويف الأنف
بمسحة واحدة من كلا الممرات الأنفية دون لمس جلد الأنف. يسلم إلى
على معدة فارغة أو بعد ساعتين من تناول الوجبة ، سائل.
1. للدفتيريا - باستخدام ملعقة مع مسحة على الحدود السليمة والمصابة
الأقمشة. في نفس الوقت مسحة من كلا الممرات الأنفية.
إذا كنت تشك في الخناق - 2 أو 3 مسحات من الحلق للتنظير الجرثومي المباشر ، واختبار السمية ، والبذر. وفقًا للإشارات - مسحة من أماكن التوطين النادرة والبلعوم والأنف. يسلم في غضون ساعتين دون انخفاض حرارة الجسم. في المساء ، ساعات الليل ، يوم الأحد ، قم بتخفيض المادة إلى بيئة تخصيب دافئة وتخزينها في منظم حرارة +37 درجة مئوية.
2. على الميكروفلورا - استخدم ملعقة بمسحة قطنية لمسح اليمين
اللوزتين ، الأقواس ، اللهاة ، اللوزتين اليسرى ، الجدار الخلفي للبلعوم. لا تلمس
الغشاء المخاطي للفم واللسان! يسلم في غضون ساعتين دون انخفاض حرارة الجسم.
3. بالنسبة للمكورات السحائية - أخذ العينات والبذر بجانب سرير المريض أو المنتج المخبري
مساعد مختبر ، علم البكتيريا من الجدار الخلفي للبلعوم الأنفي مع ملعقة
ثني المسحة بزاوية 45 في النسبة المئوية السفلية لطولها مقابل أنبوب الاختبار. التسليم و
البذر على الفور!
4. للسعال الديكي - بجانب سرير المريض أو في المختبر ، ينتج مساعد المختبر من الظهر
جدار بلعومي (غطس لأسفل) بقطعة قطن منحنية بزاوية 45 درجة. توصيل
والبذر على الفور ، دون انخفاض حرارة الجسم.
5. للفطار - باستخدام قطعة قطن من المناطق المصابة من الغشاء المخاطي. يسلم إلى
لمدة ساعتين بدون انخفاض حرارة الجسم.
مياه الغسل في البرونز
في أنبوب اختبار معقم بكمية 5 مل. يسلم في غضون ساعتين دون انخفاض حرارة الجسم.
ليكفور
الأجزاء الأخيرة بحجم 1-3 مل في أنبوب اختبار معقم وفقًا لقواعد التعقيم فوق مصباح كحول. يوضع على الفور في علبة دافئة أو يوضع على درجة 37 في منظم الحرارة.
تفريغ RAS
عالج الجلد حول الجرح مسبقًا بمحلول مطهر ، وقم بإزالة الكتل الميتة ، والمخلفات ، والقيح بمنديل معقم. يتم أخذ المادة بمسحة قطنية في حركات دورانية دائرية من المركز إلى المحيط. حسب المؤشرات - مسحتان ، واحدة لتنظير الجراثيم الأصلي.
بواسطة Cito! - 3 مسحات لتنظير الجراثيم و الزرع و الحساسية للمضادات الحيوية. إذا كان هناك تصريف في الجرح ، قسطار - الجزء الداخليتقطع بمقص معقم وتوضع في قنينة بها وسط مغذي. يسلم في غضون 1-2 ساعة دون انخفاض حرارة الجسم. خارج ساعات المختبر ، يتم أخذ المادة في وسط التخصيب وحفظها في حاضنة عند 37 درجة مئوية في المختبر السريري.
نقاط. المواد على ANAEROBE. الجروح العميقة التي يمكن التخلص منها. قطع من الأقمشة
المواد الأصلية في حقنة بحجم 0.5-3 مل ، في نهاية الإبرة - أنبوب اختبار مطاطي ، ملفوف في منديل معقم، في غضون 0.5-2 ساعة قطع من الأنسجة ، مادة محلية بكمية 0.5-3 مل ، توضع في قوارير معقمة ، أنابيب اختبار. التوصيل خلال ساعتين أو مع ثيوجليكول متوسط - التوصيل خلال 12-24 ساعة.
عيون
قبل 5-6 ساعات من التجميع ، قم بإلغاء جميع الإجراءات والأدوية. الملتحمة - بقطعة قطن مع مخاط من الخارج إلى الحافة الداخلية ، دون لمس الجلد ، بشكل منفصل عن كل عين.
سر الكيس الدمعي - بعد التدليك يتم فصله بقطعة قطن.
حواف الجفون - قم بإزالة القشور ، وأخذ مسحة من القروح الموجودة في قاعدة الرموش أو اسحب بعض الرموش واغمرها في وسط مغذي. يسلم في غضون ساعتين دون انخفاض حرارة الجسم.
الأعضاء التناسلية
قناة "C" - بقطعة قطن في المرايا قبل الفحص اليدوي ، بعد أن عالجت الجزء المهبلي من قبل بقطعة قطن مبللة بمحلول ملحي ، دون لمس جدران المهبل.
الفرج - قبل الفحص اليدوي ، بعد إدخال المرآة والمصعد ، خذ قطعة قطن من المناطق المتغيرة مرضيًا.
الرحم ، الزوائد الرحمية - أثناء الجراحة ، خذ الإفرازات وقطع الأعضاء في قنينة أو أنبوب اختبار مع وسط غذائي.
مجرى البول القابل للانفصال - بعد مرحاض الأعضاء التناسلية الخارجية ، خذ قطعة قطن ، دون لمس الجلد. يسلم في الشيشان 1-2 ساعات دون انخفاض حرارة الجسم.
وفقًا للإشارة ، بالتوازي مع أخذ المادة ، يقوم طبيب أمراض النساء (أخصائي المسالك البولية) بإعداد اللطاخات على شريحة زجاجية باستخدام مسحات قطنية معقمة منفصلة أو أدوات أمراض النساء ، وتوزيع المادة بالتساوي دون فرك قاسي وحركات سكتة حادة.
على التحلل البولي
بدون مضادات حيوية لمدة أسبوعين قبل الاستفزاز.
للرجال:
من مجرى البول ، لا تتبول لمدة 4-6 ساعات ، عالج حشفة القضيب بقطعة قطن معقمة مبللة بمحلول نيكلوريد 0.8٪ في منطقة الفتحة الخارجية. قم بإزالة القطرات الأولى من الإفرازات وزرع بعدها. إذا لم يكن هناك إفرازات ، فقم بالتجريف بملعقة فولكمان على عمق 2-3 سم ؛ 10 مل من البول الأول ، تزرع الرواسب.
بين النساء:
من مجرى البول بعد التدليك عن طريق المهبل بملعقة فولكمان في وسط مغذي.
من قناة "C" ، القبو الخلفي للمهبل بعد المعالجة المسبقة بقطعة قطن معقمة مبللة بمحلول معقم 0.8٪ كلوريد الصوديوم ، كشط بملعقة فولكمان.
يجب تسليم وسط المغذيات بعد البذر إلى المختبر في غضون ساعة واحدة أو وضعه عند 37 درجة مئوية في منظم الحرارة.
الصفراء
عند الفحص عند أخذ الصفراء إلى المختبر السريري ، افصل الأجزاء A و B و C إلى ثلاثة أنابيب اختبار معقمة بحجم 2-5 مل ، أو أثناء الجراحة باستخدام حقنة في أنبوب اختبار ، مع مراعاة قواعد التعقيم. تسليم في غضون ساعتين.
حليب الثدي
مع مراعاة قواعد التعقيم. بعد المرحاض من الغدد الثديية ، بعد صب القطرات الأولى في منديل. يسلم بكمية 1-3 مل في قوارير معقمة خلال 0.5-1 ساعة.
في حالة تلف الأذن الخارجية ، يتم علاج الجلد بـ 70 كحول ، ثم غسله بمحلول ملحي. ثم يتم جمع التفريغ من البؤرة باستخدام قطعة قطن. يسلم في غضون ساعتين دون انخفاض حرارة الجسم.
في حالة حدوث تلف في الأذن الوسطى والداخلية ، يتم فحص الثقوب والمواد التي تم الحصول عليها أثناء التدخلات الجراحية ، والتي يتم جمعها في طبق معقم أو باستخدام وسط غذائي (خارج ساعات المختبر).
1. للزحار - الأجزاء الأولى ، للسالمونيلا - الأجزاء الأخيرة ، أو
من السفينة دون أي أثر ل des. محاليل بمقدار 0.5-1 جم في أنبوب اختبار به
مادة حافظة من الجلسرين (تُحفظ في الثلاجة من لحظة تناولها حتى 12
ساعات) ، أو أصلي في حاوية معقمة. تسليم في غضون ساعتين.
2. للكوليرا - 0.5-1.5 جرام من مادة حافظة محلية أو الكوليرا.
3. ل دسباقتريوز ، الفطريات ، الممرضة المكورات العنقودية الذهبية. UPM (الانتهازية
ميكروفلورا) 1-2 جرام من البراز الأصلي في قوارير معقمة متوافقة مع
قواعد التعقيم. يسلم في غضون ساعتين دون انخفاض حرارة الجسم.
تعتبر الطريقة البكتريولوجية - عزل الثقافات النقية للميكروبات وتحديدها لاحقًا - ذات أهمية كبيرة في تشخيص الأمراض المعدية ، في دراسة الحالة الصحية والصحية للأجسام البيئية (الماء ، الهواء ، التربة ، الطعام). ومع ذلك ، فإن الخطوة الأولى في هذه التقنية هي تلقيح أو إعادة تلقيح الثقافة البكتيرية على أنواع مختلفة من وسط المغذيات. يمكن أن تكون مادة البذر عبارة عن مزارع بكتيرية مستزرعة ، وإفرازات مختلفة من الحيوانات والبشر ، وأنسجة الجثة ، والماء ، والتربة ، والغذاء. تؤخذ المواد السائلة للبذر بحلقة أو ماصة. عندما تؤخذ بواسطة حلقة ، يجب أن يشكل السائل طبقة رقيقة شفافة في الحلقة الحلقية - "مرآة". تُستخدم الماصات عندما يتم تلقيح المادة بكميات كبيرة أو مقاسة بدقة. يتم تحديد طريقة أخذ المواد الكثيفة من خلال تناسقها. عند البذر ، غالبًا ما تستخدم الحلقة البكتيرية. تتم جميع عمليات التلاعب المرتبطة بالبذر وعزل الثقافات الميكروبية على لهب الموقد. يتم إشعال الحلقة البكتيرية فوق اللهب مباشرة قبل أخذ المادة ، ثم يتم تبريد الحلقة. للقيام بذلك ، عند إعادة زرع مزرعة جرثومية من أنبوب اختبار ، يتم غمر الحلقة الساخنة في سائل تكثيف ، وعند إعادة البذر من أطباق بتري ، فإنها تلامس سطح وسط المغذيات الخالي من نمو الميكروبات. الحلقة المبردة بما فيه الكفاية لا تسبب فوران سائل التكثيف ولا تذوب الأجار عند ملامستها للوسط. بعد اكتمال البذر ، يتم حرق الحلقة مرة أخرى لتدمير الثقافة الميكروبية الموجودة عليها أو المواد المصابة بالكائنات الحية الدقيقة. ماصات وملاعق تستخدم للبذر وتغطس في محلول مطهر. بعد البذر على أطباق بتري من الأسفل ، على أنابيب الاختبار في الثلث العلوي ، يتم تسجيل اسم المادة المصنفة ، ويتم وضع رقم التحليل وتاريخ البذر.
تقنية المحاصيل على وسائط المغذيات الصلبة والسائلة: 1. عند البذر في وسط مغذي سائل ، يتم غمر الحلقة التي بها المادة الموجودة في الوسط. إذا كانت المادة لزجة ولم تتم إزالتها من الحلقة ، فإنها
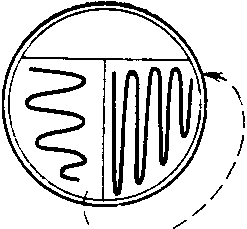
الشكل 11. مخطط نقل الميكروبات من أنبوب اختبار إلى أنبوب اختبار.
يفرك على جدار الوعاء ، ثم يغسل بوسط سائل. تُسكب المادة السائلة التي يتم جمعها في باستير أو ماصة متدرجة في وسط مغذي. 2. عند البذر على أجار اللحم المشطوف الببتون ، يؤخذ الأنبوب في اليد اليسرى بين الأصابع 1 و 2 ، بحيث تكون قاعدة الأنبوب على سطح اليد ويتم التلقيح تحت سيطرة عين. تتم إزالة الفلين من أنبوب الاختبار بأصابع اليد اليمنى V و IV ، دون لمس جزء الفلين الذي يدخل داخل أنبوب الاختبار. 3 أصابع متبقية اليد اليمنىتظل حرًا في أخذ حلقة بكتيرية يتم من خلالها إجراء البذر. الحلقة ممسكة مثل قلم الكتابة. بعد إزالة السدادة ، يتم الاحتفاظ بأنبوب الاختبار بوسط المغذيات في وضع مائل لمنع الكائنات الدقيقة الأجنبية من دخوله من الهواء. يتم إدخال الحلقة التي تحتوي على المادة الملقحة في أنبوب الاختبار إلى الأسفل ، ويتم إنزالها بشكل مسطح على سطح وسيط المغذيات ويتم تطبيق السكتة الدماغية بحركات منزلقة من أسفل إلى أعلى ، من أحد جدران أنبوب الاختبار إلى آخر ( تين.).
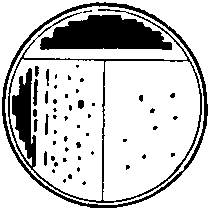
3. عند البذر على سطح وسط غذائي كثيف في أطباق بتري ، يتم إمساك الكوب في اليد اليسرى. من ناحية ، تمسك قاعها بإصبع واحد وثاني ، ومن ناحية أخرى ، بأصابع IV و V. الغطاء ، مفتوحًا بحيث يمكن للحلقة أو الملعقة أن تمر بحرية في الفجوة المتكونة ، مثبتة بأصابع 1 و III أو 1 و II (الشكل). تُفرك كمية صغيرة من مادة الاختبار بحلقة بكتيرية في سطح وسط المغذيات على حافة الطبق. ثم يتم حرق الحلقة لتدمير المواد الزائدة عليها. يبدأ خط البذر من المكان الذي توجد فيه المادة. يتم وضع الحلقة البكتيرية بشكل مسطح على وسط المغذيات حتى لا تخدش سطحها ، ويتم عمل خطوط على الوسط بأكمله أو في قطاعات ، بعد قطع قاع الطبق أولاً (بشرط أن يكون الوسط شفافًا) إلى عدة أجزاء متساوية . من الضروري المحاولة بحيث تكون السكتات الدماغية المطبقة بواسطة الحلقة قريبة قدر الإمكان من بعضها البعض ، لأن هذا يطيل خط البذر الشائع ويجعل من الممكن توزيع المادة الملقحة بالتساوي على سطح وسط غذائي كثيف ، بدلاً من يمكن استخدام حلقة أو مسحة أو ملعقة.

أرز. 12. البذر على وسط غذائي صلب في أطباق بتري.
مع وجود وفرة من الميكروبات في المادة المزروعة ، فإنها تنمو على شكل غشاء يغطي كامل سطح وسط المغذيات. تسمى هذه الخاصية للنمو الميكروبي المستمر أو العشب. تتم بذر الحشيش عندما يكون من الضروري الحصول على كميات كبيرة من الثقافة الميكروبية لنوع واحد. 4. يتم تحضير معلق من المادة المراد تلقيحها في سمك وسط مغذي كثيف في ماء الصنبور المعقم أو في محلول متساوي التوتر. جمع 0.1-1 مل من المعلق في ماصة (اعتمادا على درجة التلوث الجرثومي المتوقع) وصب في طبق بتري معقم فارغ. بعد ذلك ، يُملأ الكوب بـ 15-20 مل من آجار بيبتون اللحم ، ويُذاب ويُبرد إلى درجة حرارة 40-45 درجة مئوية (عند هذه الدرجة ، يجب ألا يتسبب أنبوب الاختبار مع الوسيط المطبق على الخد في حدوث حروق إحساس). من أجل التوزيع المنتظم لمواد الاختبار في وسط المغذيات ، يتم تدوير الكوب المغلق مع المحتويات قليلاً على سطح الطاولة. 5. يتم البذر عن طريق الحقن في عمود من وسط غذائي في أنبوب اختبار بوسط مجمد على شكل عمود. يتم أخذ الأنبوب في اليد اليسرى ، كالعادة ، وفي وسط العمود إلى أسفل الأنبوب ، يتم حقن حلقة بالمادة الموجودة عليه.
الحصول على الثقافات النقية. الثقافة النقية للميكروبات هي مجموعة من الكائنات الحية الدقيقة من نفس النوع التي تم الحصول عليها من مستعمرة ميكروبية معزولة. يقصد بالمستعمرة الميكروبية ذرية البكتيريا الناتجة عن تكاثر خلية جرثومية واحدة. يعتبر عزل الثقافة النقية للميكروبات خطوة إلزامية في أي دراسة بكتريولوجية. تعتبر الثقافة النقية ضرورية لدراسة الخصائص المورفولوجية والثقافية والثقافية والكيميائية الحيوية والمستضدية ، والتي يحدد مجموعها أنواع الكائنات الحية الدقيقة قيد الدراسة.
تم اقتراح العديد من الطرق المختلفة لعزل الثقافات النقية للميكروبات من المواد التي تحتوي على نباتات دقيقة مختلطة وفيرة. الطريقة الأكثر استخدامًا هي الفصل الميكانيكي للكائنات الحية الدقيقة الموجودة في مادة الاختبار من أجل الحصول على مستعمرات معزولة على السطح أو في عمق وسط المغذيات. يتم استخدام وسائط المغذيات الاختيارية على نطاق واسع ، مما يحفز تطور تلك الكائنات الحية الدقيقة ، والتي من المفترض أن يتم عزل الثقافة النقية. بعض أنواع الميكروبات شديدة الحساسية لعوامل بيئية معينة. تم استخدام المقاومة الفردية للميكروبات لعامل أو آخر لتطوير طرق لعزل الثقافات النقية عن طريق قتل البكتيريا المصاحبة. تستخدم هذه الطريقة لعزل أشكال البوغ من الميكروبات المقاومة درجة حرارة عالية، المتفطرة السلية ، غير مبال بعمل المحاليل المركزة للأحماض المعدنية ، على عكس الميكروبات الأخرى الموجودة في البلغم. عند عزل مزرعة نقية للميكروبات المسببة للأمراض من المواد المرضية الملوثة بالنباتات الدقيقة الدخيلة ، يلجأون أحيانًا إلى إصابة حيوانات المختبر المعرضة لنوع الميكروب الذي من المفترض عزله عن المادة قيد الدراسة. يتم استخدام الطريقة البيولوجية لعزل مزرعة نقية في دراسة البلغم لمحتوى المكورات الرئوية ، المتفطرة السلية فيه. تُعرف طرق قليلة نسبيًا لعزل البكتيريا كمزارع نقي. يتم ذلك غالبًا عن طريق عزل الخلايا الفردية على وسط مغذي صلب باستخدام طريقة البذر الخطي.
من ثقافة نقية ، عادة ما تنمو نفس المستعمرات ، ويتم الكشف عن خلايا مماثلة عن طريق الفحص المجهري ، ولا سيما في الحجم وصبغة جرام. ومع ذلك ، هناك استثناءات ممكنة ، على سبيل المثال ، قد تكون المستعمرات التي تنمو من ثقافة نقية سلسة (S) وخشنة (R). بالإضافة إلى ذلك ، قد تظهر الخلايا والأكياس والجراثيم الكروانية في الثقافات النقية للعديد من الكائنات الحية الدقيقة. أخيرًا ، تظهر بعض الكائنات الحية الدقيقة تباين الجرام. بذر السكتة الدماغية. هناك العديد من الطرق لتقسيم ألواح الوسائط الصلبة ("الألواح المخططة") ، ولكن القليل منها فقط تقريبًا يعطي مستعمرات معزولة جيدًا ، حتى في حالة عدم وجود مهارة المجرب. من الممكن أيضًا صب محاليل المزرعة المختلطة المخففة على سطح الوسائط الصلبة في الأطباق. عند العمل مع اللاهوائية ، يتم تحضين "الأطباق المخططة" أو الأطباق ذات الثقافة السائلة التي يتم إدخالها فيها في جو هوائي في منطاد لا هوائي. تتطلب اللاهوائية وسائط مُحضرة حديثًا ويجب أن يتم خطها خلال أول 4 ساعات بعد التعقيم لتجنب تراكم الأكسجين المذاب.
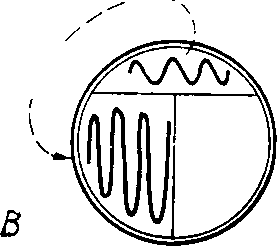
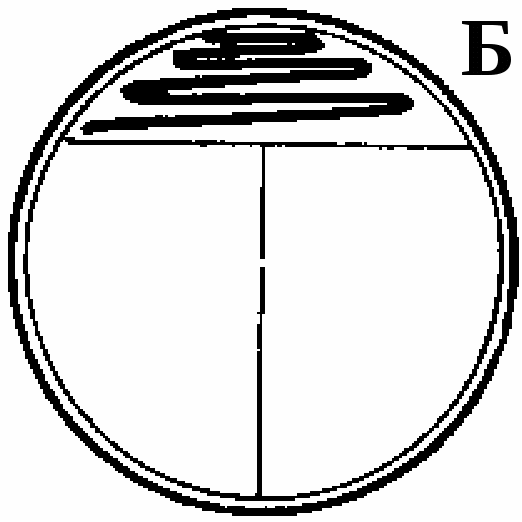
الشكل 13. طريقة لوحة خط ملائمة للمستعمرات المفردة. أ. لوضع علامة على الجانب الخلفي من طبق بتري ، يتم تطبيق حرف T بقلم رصاص ، وتقسيم الجزء السفلي إلى 3 قطاعات. B. حلقة ثقافة متعرجة مخططة على سطح الأجار في القطاع 1 كما هو موضح في الشكل. للقيام بذلك ، يتم رفع غطاء الكأس أولاً ، وبعد تطبيق السكتة الدماغية ، يتم إغلاقه على الفور. الحلقة معقمة باللهب وتترك لتبرد (15 ثانية). ج. ارسم حلقة فوق سطح الوسيط في القطاع 1 ، كما هو موضح في الشكل ، ثم قم على الفور بتطبيق الضربات معها في نمط متعرج على سطح الوسط في القطاع 2. سخن الحلقة في اللهب واتركها لتبرد. د. ارسم حلقة فوق سطح الوسيط في القطاع 2 ، كما هو موضح ، ثم قم بتطبيقه بضربة متعرجة على سطح الوسيط في القطاع 3. سطح أجار. ينمو عدد كبير من المستعمرات في القطاع 1 ، بينما تظهر المستعمرات الفردية المعزولة جيدًا في القطاعين 2 و 3.
الحصول على ثقافة نقية عن طريق الغربلة في عمق الوسط (حسب كوخ). يتم وضع ثلاثة أنابيب اختبار تحتوي على 15 مل من أجار ببتون اللحم في حمام مائي لإذابة الأجار. يتم تبريد الوسط المنصهر إلى درجة حرارة 43-45 درجة مئوية. يتم إدخال حلقة بكتيرية واحدة من مادة الاختبار في أنبوب الاختبار. لخلط المادة مع الوسط بشكل أفضل ، يتم تدوير الأنبوب الملقح عدة مرات ، مع الاحتفاظ به بين راحة اليد. بعد ذلك ، يتم نقل محتويات أنبوب الاختبار الأول بحلقة مكلسة ومبردة إلى الثاني وبنفس الطريقة من الثاني إلى الثالث. تُسكب التخفيفات المحضرة للميكروبات من أنابيب الاختبار في أطباق بتري المعقمة ، مع تمييزها بأرقام مطابقة لأرقام أنابيب الاختبار. بعد تصلب الوسيط مع مادة الاختبار ، توضع الأكواب في منظم الحرارة. يتناقص عدد المستعمرات في لوحات الاستنبات مع تخفيف المادة.
عزل الثقافة النقية حسب طريقة Drygalsky. يتم سكب وسط المغذيات المنصهرة في ثلاثة أطباق بتري. يجب تجفيف الوسط المتجمد ، لأن سطحه الرطب يساهم في تكوين نمو متكدس. تُضاف قطرة واحدة من مادة الاختبار إلى الكوب الأول وتُفرك في سطح وسط المغذيات باستخدام ملعقة معقمة. علاوة على ذلك ، بدون حرق الملعقة ودون الحصول على مادة جديدة ، يتم نقل الملعقة إلى الكوبين الثاني والثالث ، وفرك المادة المتبقية عليها في سطح وسط المغذيات. طريقة الغربلة السطحية التي اقترحها Drygalsky هي الطريقة الأكثر استخدامًا للحصول على ثقافة نقية من الميكروبات. بدلاً من الملعقة ، يمكنك استخدام حلقة. يتم توزيع المادة الموجودة على وسط المغذيات في ضربات متوازية على الطبق بأكمله في اتجاه واحد. بعد ذلك ، قلب الكوب 180 درجة ، ارسم ضربات في الاتجاه العمودي على الضربات الأولى. باستخدام طريقة البذر هذه ، يتم استهلاك المادة الموجودة في الحلقة تدريجياً ، وتنمو مستعمرات الميكروبات المعزولة على طول خطوط الشبكة المطبقة في نهاية البذر.
دراسة الخصائص الثقافية للكائنات الحية الدقيقة
يتم تحديد الخصائص الثقافية للميكروبات من خلال طبيعة نموها على وسط المغذيات. كونها ثابتة لكل نوع من أنواع الميكروبات ، فهي ميزة تشخيصية مهمة.
نمو الميكروبات على وسط غذائي صلب.لدراسة خصائص المستعمرات ، تزرع الميكروبات على وسائط مغذية كثيفة في أطباق بتري. عند زرع المادة ، يحاولون الحصول على نمو معزول للمستعمرات. يتم عرض لوحات البذر أولاً بالعين المجردة أو من خلال عدسة مكبرة ، ثم يتم وضعها بالمقلوب على مرحلة المجهر ويتم عرض المستعمرات في الضوء المنقول باستخدام عدسة تكبير منخفضة وفتحة ضيقة. تتميز المستعمرات بالحجم والشكل ومحيط الحافة والتضاريس والسطح واللون والهيكل والاتساق. حجم المستعمرة يحددها قطرها. اعتمادًا على القطر ، يتم تمييز المستعمرات على أنها منقط (قطرها أقل من 1 مم) ، صغيرة (قطرها 1-2 مم) ، متوسطة (قطرها 2-4 مم) وكبيرة (قطرها 4-6 مم أو أكثر). شكل مستعمرة أحيانًا يكون صحيحًا - دائري ، غير منتظم - أميبوي ، جذري - على شكل جذر ، يشبه جذور الأشجار المتشابكة. شخصية كفاف الحافة يتم تحديدها من خلال فحص المستعمرة تحت عدسة مكبرة أو مجهر بتكبير منخفض. يميز بين الحواف الناعمة في شكل خط محدد بوضوح وغير متساوي. وتنقسم الأخيرة إلى:
حافة صدفي ، تتكون من أسنان كبيرة مستديرة قليلاً أو مسطحة من الشكل الصحيح ؛
حافة متموجة ، تختلف نوعًا ما عن الحافة الصدفيّة من حيث أن أسنانها الكبيرة غير واضحة ؛
حافة متآكلة أو خشنة تتكون من أسنان حادة بأحجام وأشكال مختلفة ؛
حافة مهدبة مع الزغابات الرقيقة.
في بعض الحالات ، لا يوجد خط محدد بوضوح يفصل المستعمرة عن سطح الوسط. هذه الحافة من المستعمرة تسمى غامضة. إغاثة المستعمرة تتميز بارتفاعها فوق سطح وسط المغذيات ومحيط الشكل في مقطع رأسي. يتم تحديد راحة المستعمرة بالعين المجردة أو بالعدسة المكبرة عند النظر إليها من أعلى ومن الجانب.

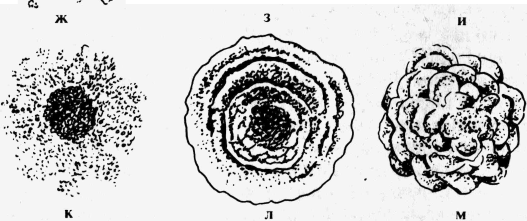
الشكل 14. شكل المستعمرات:
حول؛ ب - مستدير بحافة صدفي ؛ في- دائرية مع الأسطوانة على طول الحواف ؛ د ، د -جذمور. هـ - دائري بحافة جذمور ؛ ز - الأميبا. ح - خيطي و - مطوية. ك - خطأ ل- متحدة المركز؛ م - معقدة
نميز: 1) المستعمرات على شكل قطرة وشكل قبة الصحيح شكل دائريبدرجة مختلفة من التحدب ، والتي تمثل في المقطع الرأسي قطعة من الكرة وتختلف فقط في طول نصف القطر. المستعمرات محدبة قليلاً ولها نصف قطر كبير ؛ مقبب - أصغر ؛
2) المستعمرات مستوية محدبة ذات قمة مسطحة ، مائلة بلطف أو تنكسر بشكل مفاجئ ؛ لها شكل شبه منحرف في قسم عمودي ؛
3) مستعمرات مخروطية الشكل لها شكل مثلث في مقطع رأسي:
4) مستعمرات ذات منتصف مرتفع على شكل حلمة وأسطوانة على طول المحيط ؛
5) مستعمرات ذات مركز منخفض ؛
6) المستعمرات مسطحة ، تزحف على طول سطح الوسط. يتم فحص سطح المستعمرة باستخدام عدسة مكبرة أو تحت مجهر بتكبير منخفض. سطح المستعمرات غير لامع أو لامع مع لمعان ، جاف أو رطب ، أملس أو خشن. يتم تعيين المستعمرات الملساء بالحرف S (ناعم) ، خشن - بالحرف R (خشن) ، مما يعني "ناعم" و "خشن" على التوالي. ترجع آلية تكوين الأشكال الملساء والخشنة للمستعمرات إلى الاختلاف في عمليات انقسام الخلايا. توجد الخلايا الميكروبية في مستعمرات الشكل S ، تلامس أسطحها الجانبية ، وخلايا الشكل R ، وتحتفظ بالجسور السيتوبلازمية أثناء الانقسام ، وتشكل سلاسل تتداخل مع بعضها البعض ، وتسبب سطحًا خشنًا وحافة غير متساوية للمستعمرة.
لوحظ انتقال أشكال S إلى أشكال R أثناء التفكك. يتم ملاحظة ظاهرة التفكك في الميكروبات المسببة للأمراض تحت تأثير المضادات الحيوية والعلاج الكيميائي ، وعوامل المناعة المحددة التي تتشكل أثناء العملية المعدية ، وكذلك العوامل البيئية. من بين الأشكال الخشنة للمستعمرات ، هناك: مطوي ، دائري ، في المظهر يشبه سطح الدماغ المخططة بالتلافيف ؛ ثؤلولي ، مخططة مركزية أو نصف قطرية ؛ shagreen ، أي الحبيبات الدقيقة.
لون المستعمرة تحددها الصبغة التي تنتجها ثقافة الميكروبات. الغالبية العظمى من البكتيريا المسببة للأمراض لا تشكل صبغة ، ونتيجة لذلك تكون مستعمراتها عديمة اللون أو عكر حليبي اللون ، على غرار العقيق. في الضوء المنقول ، تكون هذه المستعمرات شفافة إلى حد ما. تعطي أنواع الميكروبات المكونة للصبغات مستعمرات بألوان مختلفة: كريم ، أصفر ، برتقالي ذهبي ، أزرق ، أحمر ، أرجواني ، أسود ، إلخ.
هيكل المستعمرات يتم تحديده في الضوء المرسل بتكبير منخفض بالمجهر ، أو فتحة ضيقة ، أو بمكثف منخفض قليلاً. في المستعمرات المصطبغة والمستعمرات التي لا تنقل الضوء ، لا يتم تحديدها.
حسب طبيعة الهيكل ، يتم تمييز أنواع المستعمرات التالية:
1) هيالين - عديم اللون وشفاف وبدون بنية محددة واضحة ؛
2) الحبيبات ، والتي ، حسب حجم الحبوب ، تنقسم إلى حبيبات ناعمة وخشنة ؛
3) خيطية أو ليفية ، وتتميز بوجود خيوط طويلة متشابكة كثيفة في سمك المستعمرة.
المستعمرات إما متجانسة أو غير متجانسة. هيكل الأول هو نفسه في جميع الأجزاء ، في الأخير يختلف الجزء المركزي عن الجزء المحيطي ، أو أن القطاعات الفردية لها هيكل يختلف عن بقية الكتلة.
اتساق المستعمرة الذي يحدد حالته الفيزيائية ، يتم فحصه عن طريق لمس أو أخذ جزء من المادة منه بحلقة بكتيرية. حسب طبيعة اتساق المستعمرة هي:
1) فطيرة ، سهلة الإزالة والتآكل على سطح وسط المغذيات مثل الزبدة ؛
2) لزج أو مخاطي ، يلتصق ويصل إلى الحلقة ؛
3) ليفية أو جلدية ، كثيفة ، تمت إزالتها من سطح وسط المغذيات في شكل غشاء مرن يتوافق مع حجم وشكل المستعمرة ؛
4) حلقات هشة وجافة تنهار عند لمسها.
ملامح النمو الميكروبي على وسط المغذيات السائلة.في وسط المغذيات السائلة ، تكون طبيعة نمو الميكروبات أقل تنوعًا من وسائط المغذيات الصلبة. ومع ذلك ، فقد تم تحديد الأشكال التالية من نمو البكتيريا هنا أيضًا.
1. نمو البكتيريا ذات التعكر المنتظم في الوسط ، لونها لا يتغير أو يتغير وفقًا للون الصبغة القابلة للذوبان في الماء المتكونة في ثقافة الميكروب. هذا النمو هو سمة من سمات العديد من البكتيريا المسببة للأمراض التي تنتمي إلى مجموعة اللاهوائية الاختيارية.
2. النمو القاعي تتميز البكتيريا بتكوين راسب في قاع أنبوب الاختبار بوسط مغذي سائل. قد تكون الرواسب هزيلة أو وفيرة ، متفتتة ، متجانسة ، ليفية أو على شكل رقائق كبيرة فضفاضة ، لزجة ، لزجة ، هشة أو عجينة في الاتساق. قد يكون وسط المغذيات فوق الرواسب صافياً أو غائماً. يتم تحديد لون المادة المترسبة والوسيط أعلاه من خلال وجود صبغة تنتجها الثقافة الميكروبية. إذا لم تشكل المزرعة صبغة ، فإن لون الوسط لا يتغير ، ويصبح الراسب ، كقاعدة عامة ، أبيض مائل للرمادي أو لون مصفر. نمو القاع خاص بالبكتيريا ذات التنفس اللاهوائي.
3. النمو الجداري يتم التعبير عن البكتيريا في حقيقة أن وسط المغذيات في أنبوب الاختبار يظل شفافًا تمامًا. تنمو البكتيريا ، وتشكل رقائق سائبة كبيرة إلى حد ما أو ، على العكس من ذلك ، حبيبات مضغوطة متصلة بالسطح الداخلي لجدران الوعاء ، والتي يتم إزالتها منها بسهولة أو بصعوبة اعتمادًا على نوع البكتيريا.
4. نمو السطح تتميز البكتيريا بظهور غشاء على سطح وسط مغذي سائل ، يمكن أن يختلف مظهره وطبيعته:
أ) الفيلم رقيق وحساس وعديم اللون وله مظهر لوحة بالكاد ملحوظة تختفي عندما يهتز الأنبوب ويهتز الوسط ؛
ب) الفيلم رطب ، سميك ، مرئي للعين المجردة ، لزج ، قوام لزج ، يلتصق بالحلقة ويمتد خلفها ؛
ج) الفيلم كثيف وجاف ويشبه قطع الجلد وعندما تحاول أخذ مادة منه تتم إزالته بالكامل على شكل قرص دائري يتوافق مع قطر أنبوب الاختبار:
د) أن يكون الفيلم كثيفًا وجافًا وله سطح متجعد وأحيانًا ثؤلولي متصل بجدران الوعاء بحوافه ؛ عند هز السائل أو لمس الحلقة البكتيرية ، فإنه ينقسم إلى قطع تغوص في عمق السائل.
يعتمد لون الفيلم ، مثل وسط النمو ، على الصبغة التي تنتجها ثقافة الميكروبات المتنامية. نمو البكتيريا على شكل طبقة سطحية هو سمة من سمات الميكروبات الهوائية.
النمو على وسط غذائي شبه سائل.للتعرف على سمات النمو الميكروبي على وسط مغذي شبه سائل ، تم زرع البذور تحت الدراسة في عمود من 0.2-0.5٪ أجار شبه سائل. من أجل أن تظهر ميزات النمو بوضوح أكبر ، يتم ثقب الوسط على مقربة من جدار أنبوب الاختبار. إن البذر الذي يتم إنتاجه بهذه الطريقة يجعل من الممكن التعرف على السلالات المتنقلة من الميكروبات وتمييزها عن السلالات غير المتحركة.
تسبب الميكروبات المتنقلة في عمود من أجار شبه سائل تعكرًا واضحًا ، وينتشر بشكل أو بآخر بالتساوي في جميع أنحاء سماكة الوسط بالكامل.
تنمو الأشكال غير المتحركة من الميكروبات فقط على طول ثقب الوسط ، وتشبه رقاقات أسطوانية أو مخروطية الشكل. في الوقت نفسه ، تظل البيئة شفافة تمامًا.
الدرس السابع: طرق دراسة الخصائص البيوكيميائية للكائنات الحية الدقيقة.
الغرض من الدرس. لدراسة التمايز البيوكيميائي للكائنات الحية الدقيقة.
المواد والمعدات. مجموعة من وسائط المغذيات. الثقافة المدروسة للكائنات الحية الدقيقة.
طرق دراسة الخصائص الحيوية للكائنات الحية الدقيقة
تلعب الإنزيمات دورًا مهمًا في حياة الميكروبات. هم مشاركون إلزاميون في تفاعلات كيميائية حيوية مختلفة تكمن وراء وظائف التغذية والتنفس والتكاثر. ينتج كل نوع من الكائنات الحية الدقيقة مجموعة ثابتة من الإنزيمات الخاصة به ، بعضها يكسر البروتينات والكربوهيدرات بدرجات متفاوتة ، بينما يتسبب البعض الآخر في أكسدة وتقليل ركائز مختلفة. يجعل استقرار الأنظمة الأنزيمية البكتيرية من الممكن استخدام الخصائص الكيميائية الحيوية للبكتيريا جنبًا إلى جنب مع ميزاتها المورفولوجية والثقافية وغيرها من السمات الثابتة لتحديد أنواع وأنواع البكتيريا. للكشف عن الإنزيمات ، يتم زرع استنبات الميكروبات قيد الدراسة على وسائط مغذية تشخيصية تفاضلية خاصة.
خصائص الحالة للسكريات من الكائنات الحية الدقيقة. إن القدرة على تكسير الكربوهيدرات والكحوليات عالية الذرات ، والتي عادة ما يتم دمجها في مجموعة واحدة تسمى السكريات ، متأصلة في العديد من الميكروبات. تحت تأثير إنزيمات البكتيريا المحللة للسكريات ، يتم تكسير السكريات إلى ألدهيدات وأحماض. المنتجات النهائية لتقسيمها هي مواد غازية: CO2 و H2. من المميزات أن أنواع مختلفةوحتى أنواع مختلفة من الميكروبات تعالج نفس السكريات بشكل مختلف. لذلك ، على سبيل المثال ، تظل بعض البكتيريا ، التي تخمر اللاكتوز ، محايدة فيما يتعلق بالجلوكوز ، والبعض الآخر ، على العكس من ذلك ، تخمر الجلوكوز ، والثالث ، الأكثر نشاطًا ، يتسبب في انهيار كل من الجلوكوز واللاكتوز. للكشف عن الإنزيمات المحللة للسكريات ، يتم تلقيح ثقافة البكتيريا المدروسة في وسط المغذيات Hiss ، ويسمى أيضًا الصف "المتنوع". عادةً ما يحتوي صف "Motley" Hiss القصير على 5 أنابيب اختبار: مع الجلوكوز واللاكتوز والمانيتول والمالتوز والسكروز. في بعض الدراسات ، من أجل دراسة أكثر تعمقًا للخصائص الكيميائية الحيوية للميكروب المعزول ، تم استكمال سلسلة Hiss بالدولسيتول ، السوربيتول ، الزيلوز ، الأرابينوز ، وبعض السكريات الأخرى. يرجع اسم السلسلة "المتنوعة" إلى حقيقة أنه تحت تأثير الإنزيمات الميكروبية ، تظل بعض الكربوهيدرات دون تغيير ، وبالتالي ، لا يتغير لون وسط المغذيات ، بينما يتم تكسير السكريات الأخرى ، وتشكيل منتجات تحلل حمضية تتغير لون المؤشر ، وبالتالي لون وسيط المغذيات. وسائط الهسهسة سائلة وشبه سائلة (مع إضافة 0.2-0.5٪ أجار أجار). في أنابيب الاختبار ذات الوسائط السائلة من Giss لاكتشاف الغازات ، وهي المنتجات النهائية لتحلل السكريات ، يتم إنزال "عوامة" - أنبوب بقطر 0.5-0.7 سم ، مغلق في أحد طرفيه. يتم وضع "Float" مع نهاية ملحومة ؛ أثناء التعقيم ، يتم ملؤها بالكامل بوسط مغذي. عندما تتشكل المنتجات الغازية في الوسط ، فإنها تحل محل جزء من السائل في "العوامة" ، ونتيجة لذلك تتجمع فقاعة الهواء في نهايتها المغلقة. في وسط Hiss شبه السائل ، يتم تحديد تكوين الغاز من خلال وجود فقاعات غاز صغيرة في سمك الوسط والرغوة الثابتة على سطحه. وهكذا ، عند دراسة الإنزيمات المحللة للسكريات التي تفرزها الميكروبات ، لا يأخذ المرء في الاعتبار فقط ظواهر انهيار بعض السكريات عن طريق تكوين الحمض ، ولكن أيضًا عمق العملية الأنزيمية من خلال وجود المنتجات الغازية النهائية في وسط المغذيات. يتم وضع أنابيب الاختبار مع مجموعة من وسائط Hiss في رف في صف واحد. يتم تمييز كل أنبوب اختبار باسم السكر الموجود في الوسط. في أنبوب الاختبار الأول لكل صف ، بالإضافة إلى اسم السكر ، حدد عدد أو نوع الثقافة الميكروبية قيد الدراسة. تؤخذ الثقافة عند طرف الحلقة بكمية صغيرة جدًا وتُزرع وفقًا للطريقة المقبولة عمومًا.
الخصائص المحللة للبروتين للكائنات الحية الدقيقة. بعض أنواع الكائنات الحية الدقيقة تنتج وتفرز في البيئة الخارجية الإنزيمات المحللة للبروتين - البروتياز الذي يحفز تكسير البروتينات. نتيجة لانقسام جزيء البروتين ، تتشكل منتجات التحلل الجزيئي العالي الوسيط - البيبتون والألبومات والببتيدات. تحت تأثير الإنزيمات المحللة للبروتين الأخرى ، تنقسم الببتونات بدورها إلى عديد الببتيدات (مركبات من اثنين أو أكثر من الأحماض الأمينية) والأحماض الأمينية الفردية. لتحديد الإنزيمات المحللة للبروتين ، يتم تلقيح ثقافة الميكروبات قيد الدراسة في وسط مغذي يحتوي على بروتين واحد أو آخر. في أغلب الأحيان ، يتم استخدام الجيلاتين لهذا الغرض ، في كثير من الأحيان - مصل اللبن الرائب أو بياض البيض المتخثر أو الحليب أو قطع اللحم المسلوق. سيظهر نشاط التحلل للبروتين لنفس الميكروب ، عند تحديده على وسائط مغذية مختلفة ، بشكل مختلف ، بسبب خصوصية الإنزيمات. لذلك ، بالنسبة لأنواع مختلفة من الميكروبات ، يوصى باستخدام وسائط مغذية ذات تركيبة مختلفة.
تحديد نشاط التحلل البروتيني للميكروبات
أ) الجيلاتين. يُسكب جيلاتين ببتون اللحم في أنابيب اختبار في عمود من 5-6 مل. يتم البذر عن طريق الحقن ، وغمر الحلقة بالثقافة قيد الدراسة بعمق في وسط المغذيات إلى قاع الأنبوب. تُترك الميكروبات القادرة على النمو في درجات حرارة منخفضة لتقف في غرفة عند درجة حرارة 20-22 درجة مئوية. يتم تحضين المحاصيل المتبقية في منظم حرارة عند 37 درجة مئوية. جنبا إلى جنب مع أنابيب الاختبار التجريبية ، يتم وضع أنبوب أو اثنين من أنابيب الاختبار مع الجيلاتين غير الملقح في ترموستات للتحكم. عند درجة حرارة 37 درجة مئوية ، يذوب الجيلاتين ، لذلك ، بعد فترة الحضانة ، يتم إنزال أنابيب الاختبار من منظم الحرارة في الماء البارد أو وضعها في الثلاجة. بعد تحويل الجيلاتين إلى جيلاتين في أنابيب اختبار التحكم ، يبدأون في مشاهدة النمو ويأخذون في الاعتبار التغيرات في الوسط الغذائي لأنابيب الاختبار. حيث ، تحت تأثير إنزيم الجيلاتيناز ، تحلل بروتينات الجيلاتين ، تم تسييل وسط المغذيات. أنابيب الاختبار التي يبقى فيها الوسط دون تغيير بعد ترك حضانة يومية في منظم حرارة ، تتم مراقبة التغيير في الوسط لمدة 20 يومًا. في بروتوكول الدراسة ، يجب ملاحظة يوم ظهور علامات تميع الوسط ، ودرجة وطبيعة تسييله.
ب) على أجار حليب أيكمان. يتم تلقيح أجار حليب إيكمان ، الذي يُسكب ويُبرد في أطباق بتري ، بثقافة الميكروبات المدروسة. يتم البذر بحلقة أو ملعقة للحصول على مستعمرات معزولة. بعد 24-48 ساعة من الحضانة في منظم الحرارة ، تتسبب الثقافات التي تنتج إنزيمًا مُحللًا للبروتين في إضفاء الحيوية على بروتين الحليب - الكازين ، ونتيجة لذلك تتشكل مناطق شفافة حول هذه المستعمرات ، والتي تبرز بوضوح مقابل الخلفية العامة الغائمة للبروتين. متوسط.
ج) على مصل الدم المتخثر. يتم تلقيح ثقافة الميكروبات الهوائية المدروسة في أكواب ، الميكروبات اللاهوائية - مع حقنها في عمود من مصل الحصان المتخثر ، المحتضن في ترموستات عند 37 درجة مئوية. السلالات المنتجة للإنزيمات المحللة للبروتين ، والتي تخفف وسط المغذيات ، تشكل المنخفضات حول المستعمرات أو على سطح العمود المتوسط.
د) في مرق الدجاج بياض البيضة. في أنبوب اختبار مع مرق ببتون اللحم أو مرق Hottinger المحتوي على قطعة من بروتين الدجاج المطوي ، يتم إدخال حلقة واحدة من ثقافة الميكروبات قيد الدراسة. تتم مشاهدة المحاصيل يوميا لمدة 5 أيام. تكسر مزارع الميكروبات النشطة بروتينًا بياض البيض المتخثر ؛ تتناقص قطع البروتين الموجودة في الوسط بشكل ملحوظ في الحجم ، وتتحول إلى كتلة متفتتة ، أو تذوب تمامًا. وبالمثل ، تتجلى الخصائص المحللة للبروتين للميكروبات في الوسائط التي تحتوي على قطعة من اللحم المسلوق.
تمتلك بعض أنواع الميكروبات المسببة للأمراض ذات النشاط التحلل للبروتين القدرة على تكسير البروتين والببتون إلى نواتج تسوس عميق: الإندول وكبريتيد الهيدروجين واليوريا والأمونيا. عند تحديد أنواع وتمايز أنواع الميكروبات المسببة للأمراض ، فإن تحديد أول منتجين: الإندول وكبريتيد الهيدروجين له أهمية قصوى.
تحديد اندول في ثقافة الكائنات الحية الدقيقة. يتكون الإندول من انهيار حمض حلقية غير متجانسة معقد - التربتوفان. للكشف عن تكوين الإندول ، يتم تلقيح حلقة من الثقافة قيد الدراسة في وسط Strogoff أو أي وسائط أخرى موصى بها للكشف عن الإندول. مباشرة بعد التلقيح ، يتم إدخال شريط من ورق المؤشر مشرب بمحلول حمض الأكساليك في أنبوب الاختبار بحيث لا تلمس ورقة المؤشر وسط المغذيات. للقيام بذلك ، يتم ضغط الثلث العلوي من شريط الورق بسدادة على جدار أنبوب الاختبار. يتم تحضين المحاصيل لمدة 24-48 ساعة عند درجة حرارة 37 درجة مئوية. يتم تحديد تكوين الإندول من خلال تلوين الطرف السفلي من ورقة المؤشر بلون وردي باهت ، يمكن رؤيته بوضوح في الضوء المنقول.
تعريف كبريتيد الهيدروجين. كبريتيد الهيدروجين هو المنتج النهائي لتفكك الأحماض الأمينية: السيستين والسيستين والميثيونين المحتوي على الكبريت. يتم تلقيح حلقة من الثقافة الميكروبية المدروسة في أنبوب اختبار مع مرق ببتون اللحم أو مرق هوتينجر. مباشرة بعد التلقيح ، يضاف شريط من ورق المؤشر مشرب بخلات الرصاص إلى أنبوب الاختبار لتحديد كبريتيد الهيدروجين. في الحالات الإيجابية ، يتحد كبريتيد الهيدروجين المتكون في المزرعة مع أسيتات الرصاص عديم اللون ويتحول إلى كبريتات الرصاص ، مما يعطي ورقة المؤشر لونًا بنيًا أسودًا.
يتم إجراء المحاسبة النهائية لنتائج تكوين الإندول وكبريتيد الهيدروجين في اليوم 7-10 بعد البذر ، نظرًا لأن عملية الانقسام الأنزيمي للبروتين وتكوين المنتجات النهائية للتحلل تحدث أحيانًا لفترة طويلة.
خصائص الأكسدة والاختزال للكائنات الحية الدقيقة. يمكن العثور على إنزيمات الأكسدة والاختزال المرتبطة بشكل أساسي بوظيفة الجهاز التنفسي للكائن الحي في الثقافة الميكروبية. كما هو معروف ، يمكن أن تحدث عملية أكسدة الركيزة عن طريق ربط الأكسجين بها بمشاركة إنزيمات أوكسيديز أو عن طريق إزالة الهيدروجين منها بمشاركة إنزيمات ديهيدراز. يتميز هذا النوع من التفاعل بحقيقة أن أكسدة مادة ما دائمًا ما تكون مصحوبة باختزال (اختزال) مادة عضوية أخرى. تسمى المادة الأولى التي ينفصل منها الهيدروجين بالمتبرع ، وتسمى المادة التي يرتبط بها بالمتقبل. غالبًا ما يكون متقبل الهيدروجين هو أكسجين الهواء ، ولكن يمكن أيضًا أن يكون العديد من المركبات العضوية التي يمكن أكسدة وتقليلها بسهولة. من أجل تحديد إنزيمات ديهيدراز وتحديد نشاطها في ممارسة البحث الميكروبيولوجي ، تم اقتراح طريقة تعتمد على إدخال صبغة عضوية في وسط المغذيات ، والتي تعمل كمستقبل للهيدروجين. نتيجة لإضافة الهيدروجين ، يتم تقليل الصبغة ، وتتحول إلى مركب عديم اللون يسمى leucobase. مع وفرة من الأكسجين ، يمكن أن يتأكسد مرة أخرى ويكتسب لونه السابق. يتم استخدام الميثيلين الأزرق ، صبغة عباد الشمس ، الملكيت الأخضر ، القرمزي النيلي ، الأحمر المحايد ، وما إلى ذلك كمتقبل للهيدروجين. للكشف عن الخصائص المختزلة للكائنات الحية الدقيقة ، تتم إضافة هذه الأصباغ إلى وسائط المغذيات المعتادة: مرق ببتون اللحم ، ببتون اللحم أجار والحليب. يتصرف نفس النوع من الميكروبات بشكل مختلف فيما يتعلق بالدهانات ذات التركيب المختلف. تُستخدم خاصية الميكروب هذه في الممارسة الميكروبيولوجية كميزة تفاضلية. تعمل بكتيريا التيفود على تقليل الميثيلين الأزرق ولكنها لا تقلل عباد الشمس ولا تغير اللون الأحمر المحايد ، على عكس الإشريكية القولونية التي تظل محايدة للأزرق الميثيلين ولكنها تقلل عباد الشمس والأحمر المحايد.
تحديد قدرة الاختزال.
1. في 5 مل من الحليب المتوسط مع الميثيلين الأزرق - تلقيح حلقة من المزرعة المدروسة من وسط مغذي كثيف أو 0.1 مل من مزرعة مرق مدتها 18 ساعة ، وبعد ساعة من الحضانة ، تؤخذ نتائج النمو في الاعتبار . مع رد فعل إيجابي على اختزال الميثيلين الأزرق ، يتحول الوسط من اللون الأزرق إلى اللون الكريمي ، ومع رد فعل إيجابي ضعيف ، يكتسب لونًا أخضر.
2. أنابيب الاختبار مع حليب عباد الشمس ، يتم تلقيح وسط Minkevich بنفس طريقة تلقيح الحليب مع الميثيلين الأزرق ، وهي مزرعة يومية من وسط غذائي صلب أو سائل. يتم تحضين المحاصيل في منظم الحرارة لمدة 10 أيام ، مع ملاحظة التغير في لون الوسط يوميًا. يتجلى تقليل عباد الشمس من خلال التلون الكامل للحليب ، الذي يكون لونه وردي أرجواني قبل البذر. في بروتوكول الدراسة ، يُشار إلى تقليل عباد الشمس بالحرف P.
يسمح وسيط Minkevich أيضًا باكتشاف تكوين الحمض أو القلوي ، والذي يتم التعبير عنه ، على التوالي ، في احمرار أو زرقة بيئة الحليب. يُشار إلى تكوين الحمض بالحرف K ، القلوي - بالحرف W.
تحديد إنزيم الكاتلاز. بعض أنواع الكائنات الحية الدقيقة التي تنتمي إلى مجموعة الأيروبس ، أثناء عملية التنفس ، تشكل بيروكسيد الهيدروجين ، وهو سم خلوي. لا تصل كمية بيروكسيد الهيدروجين في المزرعة إلى تركيزات عالية أبدًا ، حيث أنه يتحلل البيروكسيد إلى ماء وأكسجين جزيئي بمشاركة إنزيم الكاتلاز. على سطح مزرعة جرثومية نمت على وسط مغذي كثيف في طبق بتري ، يتم تطبيق 1-2 مل من محلول بيروكسيد الهيدروجين 1٪ بحيث يغطي سطح المستنبت بطبقة رقيقة. يشير ظهور فقاعات الغاز في طبقة السائل المطبق إلى تكوين الأكسجين نتيجة لانقسام بيروكسيد الهيدروجين تحت تأثير الكاتلاز. تم تمييز نتيجة مماثلة في بروتوكول التجربة بعلامة + كنتيجة إيجابية لرد الفعل على الكاتلاز.
الدرس الثامن: طرق البحث الميكروبيولوجي للمياه والهواء والتربة.
استهدافالدروس.تعرف على قواعد أخذ عينات المياه والتربة وإرسالها للبحث. حدد العدد الإجمالي للكائنات الحية الدقيقة في 1 جم أو 1 مل. افحص الهواء بالترسيب (طريقة كوخ).
المعدات والمواد.قوارير معقمة بسدادة ، أنابيب اختبار مع 9 مل من الماء المعقم في كل منها ، أطباق بتري معقمة ملفوفة بالورق. ماصات معقمة (2 مل لكل منهما). أنابيب بها MPA منصهرة ، 12 مل لكل منها. حلقات ميكروبيولوجية. الشرائح وأغطية. محلول لوغول. زيت الأرز. الشعلات.
تقنية زرع الكائنات الحية الدقيقة الطريقة البكتريولوجية - عزل الثقافات النقية للميكروبات وتحديدها لاحقًا - لها أهمية كبيرة في تشخيص الأمراض المعدية ، في دراسة الحالة الصحية والصحية للأشياء البيئية (الماء ، الهواء ، التربة ، الغذاء ) ودراستها وفقًا للمؤشرات الوبائية والوبائية للإصابة بالأنواع الميكروبية المسببة للأمراض. ومع ذلك ، فإن الخطوة الأولى في هذه التقنية هي تلقيح أو إعادة تلقيح الثقافة البكتيرية على أنواع مختلفة من وسط المغذيات.
يمكن أن تكون مادة البذر عبارة عن مزارع بكتيرية مستزرعة ، وإفرازات مختلفة من الحيوانات والبشر ، وأنسجة الجثة ، والماء ، والتربة ، والغذاء.
تؤخذ المواد السائلة للبذر بحلقة أو ماصة. عندما تؤخذ مع حلقة ، يجب أن يشكل السائل طبقة رقيقة شفافة في الحلقة الحلقية - "مرآة". تُستخدم الماصات عندما يتم تلقيح المادة بكميات كبيرة أو مقاسة بدقة.
أرز. أربعة. مخطط نقل الثقافة الميكروبية من أنبوب الاختبار إلى أنبوب الاختبار
يتم تحديد طريقة أخذ المواد الكثيفة من خلال تناسقها. عند البذر ، غالبًا ما تستخدم الحلقة البكتيرية. تتم جميع عمليات التلاعب المرتبطة بالبذر وعزل الثقافات الميكروبية على لهب الموقد. يتم إشعال الحلقة البكتيرية فوق اللهب مباشرة قبل أخذ المادة ، ثم يتم تبريد الحلقة. للقيام بذلك ، عند إعادة زرع مزرعة جرثومية من أنبوب اختبار ، يتم غمر الحلقة الساخنة في سائل تكثيف ، وعند إعادة البذر من أطباق بتري ، فإنها تلامس سطح وسط المغذيات الخالي من نمو الميكروبات. الحلقة المبردة بما فيه الكفاية لا تسبب فوران سائل التكثيف ولا تذوب الأجار عند ملامستها للوسط. بعد اكتمال البذر ، يتم حرق الحلقة مرة أخرى لتدمير الثقافة الميكروبية الموجودة عليها أو المواد المصابة بالكائنات الحية الدقيقة.
يتم حرق الماصات والملاعق المستخدمة في البذر ، وكذلك الحلقات البكتيرية ، قبل البذر ، وبعد البذر ، يتم غمسها في محلول مطهر.
قبل البذر ، يتم فحص جميع الأطباق للتأكد من سلامتها ، ثم على أطباق بتري من الأسفل ، وعلى أنابيب الاختبار في الثلث العلوي ، يقومون بتسجيل اسم المادة الملقحة أو وضع رقم التحليل وتاريخ البذر.
تقنية المحاصيل على وسائط المغذيات الصلبة والسائلة
1. عند البذر في وسط مغذي سائل ، يتم غمر الحلقة التي بها المادة الموجودة في الوسط. إذا كانت المادة لزجة ولم يتم إزالتها من الحلقة ، يتم فركها على جدار الوعاء ، ثم يتم غسلها بوسط سائل. تُسكب المادة السائلة التي يتم جمعها في باستير أو ماصة متدرجة في وسط مغذي.2. عند البذر على أجار اللحم المشطوف الببتون ، خذ أنبوب الاختبار في اليد اليسرى بين الإصبع الأول والثاني بحيث تكون قاعدة الأنبوب على سطح اليد ويتم التلقيح تحت سيطرة عين. تتم إزالة الفلين من أنبوب الاختبار بأصابع اليد اليمنى V و IV ، دون لمس جزء الفلين الذي يدخل داخل أنبوب الاختبار. تظل الأصابع الثلاثة المتبقية من اليد اليمنى حرة في أخذ الحلقة البكتيرية ، والتي يتم من خلالها إجراء البذر. الحلقة ممسكة مثل قلم الكتابة. بعد إزالة السدادة ، يتم الاحتفاظ بأنبوب الاختبار بوسط المغذيات في وضع مائل لمنع الكائنات الدقيقة الأجنبية من دخوله من الهواء.
يتم إدخال الحلقة مع المادة الملقحة عليها في أنبوب الاختبار إلى الأسفل ، ويتم إنزالها بشكل مسطح على سطح وسط المغذيات ، ويتم تطبيق ضربة بحركات منزلقة من أسفل إلى أعلى ، من جدار أنبوب الاختبار إلى آخر (الشكل 4).
3. عند البذر على سطح وسط غذائي كثيف في أطباق بتري ، يتم إمساك الكوب في اليد اليسرى. من ناحية ، تمسك قاعها بإصبعين الأول والثاني ، ومن ناحية أخرى ، بأصابع الرابع والخامس. الغطاء مفتوح قليلاً بحيث تمر الحلقة أو الملعقة بحرية في الفجوة ، ويتم تثبيته بأصابع I و III أو I و II. تُفرك كمية صغيرة من مادة الاختبار بحلقة بكتيرية في سطح وسط المغذيات على حافة الطبق (الشكل 5). ثم يتم حرق الحلقة لتدمير المواد الزائدة عليها. يبدأ خط البذر من المكان الذي توجد فيه المادة. يتم وضع الحلقة البكتيرية بشكل مسطح على وسط المغذيات حتى لا تخدش سطحها ، ويتم عمل خطوط على الوسط بأكمله أو في قطاعات ، بعد قطع قاع الطبق أولاً (بشرط أن يكون الوسط شفافًا) إلى عدة أجزاء متساوية . يجب توخي الحذر للحفاظ على السكتات الدماغية المطبقة بواسطة الحلقة قريبة قدر الإمكان من بعضها البعض ، لأن هذا يطيل خط البذر الكلي ويجعل من الممكن الحصول على مستعمرات معزولة من الكائنات الحية الدقيقة.

أرز. 5. البذر على وسط غذائي صلب في أطباق بتري
من أجل التوزيع المنتظم للمادة الملقحة على سطح وسط غذائي كثيف ، يمكن استخدام مسحة أو ملعقة بدلاً من الحلقة.
مع وجود وفرة من الميكروبات في المادة المزروعة ، فإنها تنمو على شكل غشاء يغطي كامل سطح وسط المغذيات. تسمى هذه الخاصية للنمو الميكروبي المستمر أو العشب. تتم بذر الحشيش عندما يكون من الضروري الحصول على كميات كبيرة من الثقافة الميكروبية لنوع واحد.
4. يتم تحضير معلق من المادة المراد تلقيحها في سمك وسط مغذي كثيف في ماء الصنبور المعقم أو في محلول متساوي التوتر. جمع 0.1-1 مل من المعلق في ماصة (اعتمادا على درجة التلوث الجرثومي المتوقع) وصب في طبق بتري معقم فارغ. بعد ذلك ، يُملأ الكوب بـ 15-20 مل من آجار بيبتون اللحم ، ويُذاب ويُبرد إلى درجة حرارة 40-45 درجة مئوية (عند هذه الدرجة ، يجب ألا يتسبب أنبوب الاختبار مع الوسيط المطبق على الخد في حدوث حروق إحساس). من أجل التوزيع المنتظم لمواد الاختبار في وسط المغذيات ، يتم تدوير الكوب المغلق مع المحتويات قليلاً على سطح الطاولة.
5. يتم البذر عن طريق الحقن في عمود من وسط غذائي في أنبوب اختبار بوسط مجمد على شكل عمود. يتم أخذ الأنبوب في اليد اليسرى ، كالعادة ، وفي وسط العمود إلى أسفل الأنبوب ، يتم حقن حلقة بالمادة الموجودة عليه.
الحصول على ثقافات نقية
الثقافة النقية للميكروبات هي مجموعة من الكائنات الحية الدقيقة من نفس النوع التي تم الحصول عليها من مستعمرة ميكروبية معزولة. يقصد بالمستعمرة الميكروبية ذرية البكتيريا الناتجة عن تكاثر خلية جرثومية واحدة.يعتبر عزل الثقافة النقية للميكروبات خطوة إلزامية في أي دراسة بكتريولوجية. تعتبر الثقافة النقية ضرورية لدراسة الخصائص المورفولوجية والثقافية والثقافية والكيميائية الحيوية والمستضدية ، والتي يحدد مجموعها أنواع الكائنات الحية الدقيقة قيد الدراسة.
تم اقتراح العديد من الطرق المختلفة لعزل الثقافات النقية للميكروبات من المواد التي تحتوي على نباتات دقيقة مختلطة وفيرة. الطريقة الأكثر استخدامًا هي الفصل الميكانيكي للكائنات الحية الدقيقة الموجودة في مادة الاختبار من أجل الحصول على مستعمرات معزولة على السطح أو في عمق وسط المغذيات.
يتم استخدام وسائط المغذيات الاختيارية على نطاق واسع ، مما يحفز تطور تلك الكائنات الحية الدقيقة ، والتي من المفترض أن يتم عزل الثقافة النقية.
بعض أنواع الميكروبات شديدة الحساسية لعوامل بيئية معينة. تم استخدام المقاومة الفردية للميكروبات لعامل أو آخر لتطوير طرق لعزل الثقافات النقية عن طريق قتل البكتيريا المصاحبة. تستخدم هذه الطريقة لعزل الأشكال البوغية من الميكروبات المقاومة لدرجات الحرارة المرتفعة ، المتفطرة السلية ، والتي لا تبالي بفعل المحاليل المركزة للأحماض المعدنية ، على عكس الميكروبات الأخرى الموجودة في البلغم.
عند عزل مزرعة نقية للميكروبات المسببة للأمراض من المواد المرضية الملوثة بالنباتات الدقيقة الدخيلة ، يلجأون أحيانًا إلى إصابة حيوانات المختبر المعرضة لنوع الميكروب الذي من المفترض عزله عن المادة قيد الدراسة. يتم استخدام الطريقة البيولوجية لعزل مزرعة نقية في دراسة البلغم لمحتوى المكورات الرئوية ، المتفطرة السلية فيه.
تُعرف طرق قليلة نسبيًا لعزل البكتيريا كمزارع نقي. يتم القيام بذلك بشكل شائع عن طريق عزل خلايا مفردة على وسط مغذي صلب باستخدام طريقة التلقيح الخطي أو عن طريق صب كمية صغيرة من الثقافة السائلة في أكواب. ومع ذلك ، فإن الحصول على مستعمرة واحدة لا يضمن دائمًا نقاء الثقافة ، حيث يمكن أن تنمو المستعمرات ليس فقط من الخلايا الفردية ، ولكن من مجموعاتها. إذا كانت الكائنات الحية الدقيقة تشكل مخاطًا ، فغالبًا ما يتم ربط الأشكال الأجنبية بها. في حالة عزل السلالات عصيةأو الفطريات الشعاعية ، يمكن أن تتشابك الكائنات الحية الدقيقة الملوثة في سلاسل من الخلايا أو ، على التوالي ، خيوط هذه الميكروبات. يُفضل استخدام الوسيط غير الانتقائي للتنظيف ، حيث تنمو الملوثات عليه بشكل أفضل ويسهل اكتشافها. ولكن حتى في وسط غير انتقائي ، لا ينبغي اختيار المستعمرات بسرعة كبيرة ، لأن البكتيريا الملوثة التي تنمو ببطء قد لا تنمو في فترة زمنية معينة.
من ثقافة نقية ، عادة ما تنمو نفس المستعمرات ويتم الكشف عن الخلايا المماثلة عن طريق الفحص المجهري ، لا سيما في الحجم وصمة جرام. ومع ذلك ، هناك استثناءات ممكنة ، على سبيل المثال ، قد تكون المستعمرات التي تنمو من ثقافة نقية سلسة (S) وخشنة (R). بالإضافة إلى ذلك ، قد تظهر الخلايا والأكياس والجراثيم الكروانية في الثقافات النقية للعديد من الكائنات الحية الدقيقة. أخيرًا ، تظهر بعض الكائنات الحية الدقيقة تباين الجرام. ومع ذلك ، تستخدم هذه المعايير على نطاق واسع في تحديد نقاء الثقافات.
بذر السكتة الدماغية
هناك العديد من الطرق للتقطيع على ألواح الوسائط الصلبة ("الألواح المخططة") ، ولكن القليل منها فقط تقريبًا يعطي مستعمرات معزولة ، حتى في حالة عدم وجود مهارة المجرب. من الممكن أيضًا صب محاليل المزرعة المختلطة المخففة على سطح الوسائط الصلبة في الأطباق. عند العمل مع اللاهوائية ، يتم تحضين "الأطباق المخططة" أو الأطباق ذات الثقافة السائلة التي يتم إدخالها فيها في جو هوائي في منطاد لا هوائي. تتطلب اللاهوائية وسائط مُحضرة حديثًا ويجب أن يتم خطها خلال أول 4 ساعات بعد التعقيم لتجنب تراكم الأكسجين المذاب.

في  جي
جي
 د
د
أرز. 6. طريقة لوحة خط ملائمة للمستعمرات المفردة. أ. لوضع علامة على الجانب الخلفي من طبق بتري ، يتم تطبيق حرف T بقلم رصاص ، وتقسيم الجزء السفلي إلى 3 قطاعات. B. حلقة ثقافة متعرجة مخططة على سطح الأجار في القطاع 1 كما هو موضح في الشكل. للقيام بذلك ، يتم رفع غطاء الكأس أولاً ، وبعد تطبيق السكتة الدماغية ، يتم إغلاقه على الفور. الحلقة معقمة باللهب وتترك لتبرد (15 ثانية). ج. ارسم حلقة فوق سطح الوسيط في القطاع 1 ، كما هو موضح في الشكل ، ثم قم على الفور بتطبيق الضربات معها في نمط متعرج على سطح الوسط في القطاع 2. سخن الحلقة في اللهب واتركها لتبرد. د. ارسم حلقة فوق سطح الوسيط في القطاع 2 ، كما هو موضح ، ثم قم بتطبيقه بضربة متعرجة على سطح الوسيط في القطاع 3. على سطح الأجار. ينمو عدد كبير من المستعمرات في القطاع 1 ، بينما تظهر المستعمرات الفردية المعزولة جيدًا في القطاعين 2 و 3.
الحصول على ثقافة نقية عن طريق الغربلة في عمق الوسط (حسب كوخ)
يتم وضع ثلاثة أنابيب تحتوي على 15 مل من أجار ببتون اللحم في حمام مائي لإذابة الأجار. يتم تبريد الوسط المنصهر إلى درجة حرارة 43-45 درجة مئوية. يتم إدخال حلقة بكتيرية واحدة من مادة الاختبار في أنبوب الاختبار. لخلط المادة مع الوسط بشكل أفضل ، يتم تدوير الأنبوب الملقح عدة مرات ، مع الاحتفاظ به بين راحة اليد. بعد ذلك ، يتم نقل محتويات أنبوب الاختبار الأول بحلقة مكلسة ومبردة إلى الثاني وبنفس الطريقة من الثاني إلى الثالث. تُسكب التخفيفات المحضرة للميكروبات من أنابيب الاختبار في أطباق بتري المعقمة ، مع تمييزها بأرقام مطابقة لأرقام أنابيب الاختبار.بعد تصلب الوسيط مع مادة الاختبار ، توضع الأكواب في منظم الحرارة. يتناقص عدد المستعمرات في لوحات الاستنبات مع تخفيف المادة.
عزل الثقافة النقية حسب طريقة Drygalsky
يتم سكب وسط المغذيات المنصهرة في ثلاثة أطباق بتري. يجب تجفيف الوسط المتجمد ، لأن سطحه الرطب يساهم في تكوين نمو متكدس. تُضاف قطرة واحدة من مادة الاختبار إلى الكوب الأول وتُفرك في سطح وسط المغذيات باستخدام ملعقة معقمة. علاوة على ذلك ، بدون حرق الملعقة ودون الحصول على مادة جديدة ، يتم نقل الملعقة إلى الكوبين الثاني والثالث ، وفرك المادة المتبقية عليها في سطح وسط المغذيات.طريقة الغربلة السطحية التي اقترحها Drygalsky هي الطريقة الأكثر استخدامًا للحصول على ثقافة نقية من الميكروبات. بدلاً من الملعقة ، يمكنك استخدام حلقة. يتم توزيع المادة الموجودة على وسط المغذيات في ضربات متوازية على الطبق بأكمله في اتجاه واحد. بعد ذلك ، قلب الكوب 180 درجة ، ارسم ضربات في الاتجاه العمودي على الضربات الأولى. باستخدام طريقة البذر هذه ، يتم استهلاك المادة الموجودة في الحلقة تدريجياً ، وتنمو مستعمرات الميكروبات المعزولة على طول خطوط الشبكة المطبقة في نهاية البذر.



