هو غاز ، بدأت أهميته في وجود الحياة على هذا الكوكب منذ مليارات السنين. وفقًا للتخمينات الحديثة ، ظهر الهيدروجين (H2) منذ حوالي 14 مليار سنة. ليس له لون أو رائحة ، وهو أخف عنصر في الجدول الدوري للعناصر الكيميائية ، كتلته الذرية 1.00794. يحتوي الهيدروجين على بنية بلورية سداسية وعند درجة حرارة 0 درجة مئوية تكون كثافته 0.09099 جم / لتر.
يمكن اعتباره غازًا "أرستقراطيًا" ، حيث اكتشفه الفيلسوف البريطاني والفيزيائي والكيميائي من أصل نبيل هنري كافنديش عام 1766 ، وحصل على اسمه في عام 1783 بفضل الفيزيائي الفرنسي من أصل نبيل أنطوان لافوازييه. . فضل اللورد كافنديش تسمية اكتشافه بأنه "هواء قابل للاحتراق". كان اللورد كافديش الثري بشكل خيالي خجولًا ومنطويًا لدرجة أن أحد ممتلكاته كان لديه درج منفصل إلى المدخل بسبب حقيقة أنه لا يستطيع التواصل مع الخدم ، وخاصة الإناث ، الذين كان خجولًا بشكل خاص ولم يتواصل معهم إلا من خلال الملاحظات. وفقًا للافتراضات الحديثة ، كان هنري كافنديش يعاني من متلازمة أسبرجر.
أما بالنسبة لأنطوان لافوازييه ، فقد كانت نهايته حزينة: بعد كل الأعمال العلمية المهمة ، حرم الفلاحون الفرنسيون من رأسه بمساعدة مقصلة أثناء الثورة الفرنسية. بعد أسابيع قليلة من الحادث ، اعترفوا بخطئهم واعتذروا لعائلة أنطوان لافوازييه ، وفي وقت لاحق أقاموا تمثالًا على شرفه. ولكن بسبب نقص الأموال ، تم إرفاق رأس رجل آخر بتمثال لافوازييه. يبدو الأمر مثيرًا للسخرية ، أليس كذلك؟
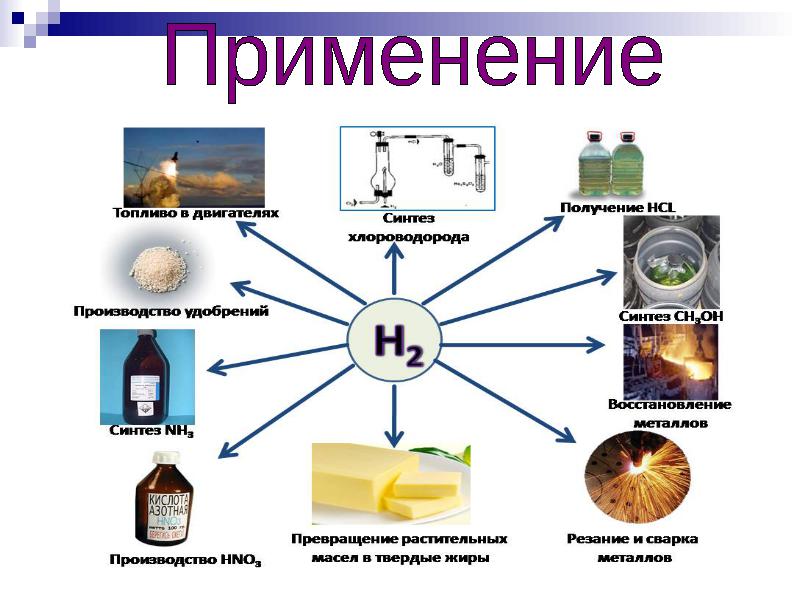
القدرة على التكيف مذهلة بكل بساطة. الهيدروجين قادر على إنتاج الكهرباء ، وهذا هو سبب استخدامه في خلايا الوقود ، ولأنه الخيار الأنظف ، في محركات الاحتراق الداخلي.
نشأ الهيدروجين نتيجة للانفجار العظيم ، ومنذ ذلك الحين ، يعمل في مجالات مختلفة على الأرض. على مدى الثلاثة مليارات ونصف المليار سنة الماضية ، شاركت بنشاط في إنتاج الماء ، فضلاً عن ولادة الحياة الخلوية والحفاظ عليها.
اليوم ، يخضع الهيدروجين (H2) لفحص شديد في البحوث الطبية. أثبتت مئات الدراسات العلمية الإمكانات العلاجية للمياه الغنية بالهيدروجين لأكثر من 140 نموذجًا مختلفًا من الأمراض.
فيما يلي لمحة موجزة عن بعض الإمكانيات العلاجية للهيدروجين وماء الهيدروجين:
- يقلل من التوتر السطحي للخلايا ، مما يسمح لها بامتصاص العناصر الغذائية بشكل أفضل.
- هذا هو الأصغر مع التوافر البيولوجي العالي.
- يقضي الهيدروجين فقط على أكثرها تدميرًا ، ويحولها إلى مياه آمنة بدون أي نفايات سامة.
- يعزز عمل مضادات الأكسدة مثل الجلوتاثيون والأكسيد الفائق.
- يساعد في تنفيذ الترطيب المناسب للخلايا.
- يقلل ماء الهيدروجين حمض اللاكتيك وبالتالي يخفف آلام العضلات أثناء وبعد التمرين.
- يعزز إنتاج ATP في الميتوكوندريا.
- يعزز ماء الهيدروجين وظيفة الميتوكوندريا في الدماغ ، وبالتالي يحسن نشاط الدماغ. كما أنه يحافظ على توازن السكر والكوليسترول.
- ماء الهيدروجين له تأثير مضاد للالتهابات ويحمي من الآثار الضارة للإشعاع. لذلك ، يتم تحديد الاستخدام من قبل رواد الفضاء أثناء الرحلة.
- له تأثير مضاد للحساسية.
اقرأ المقال
منذ العصور القديمة ، عرف الناس مواد يمكنها إذابة معادن معينة. المحاليل الضعيفة لهذه المواد لها طعم حامض ، لذلك يطلق عليها اسم "الأحماض". على سبيل المثال ، يوجد حامض الستريك في الليمون ، وحمض الماليك في التفاح. المادة التي لها الصيغة الكيميائية H 2 SO 4 تسمى حمض الكبريتيك.
جرب العديد من الباحثين الأحماض. لقد لوحظ أنه عندما تعمل الأحماض على بعض المعادن ، يتم إطلاق فقاعات الغاز. كان الغاز الناتج شديد الاشتعال وكان يسمى "الهواء القابل للاشتعال".
تمت دراسة خصائص هذا الغاز بالتفصيل من قبل العالم الإنجليزي جي كافنديش في عام 1766. وضع المعادن في محاليل من أحماض الكبريتيك والهيدروكلوريك وفي جميع الحالات تلقى نفس المادة الغازية الخفيفة ، والتي سميت فيما بعد بالهيدروجين.
دعونا نعطي أمثلة على معادلات تفاعلات تفاعل معدن مع حمض ، يتم خلالها تكوين الهيدروجين. عندما يتفاعل الحديد مع حامض الهيدروكلوريكيتكون كلوريد الحديد (II) والهيدروجين. عندما يتفاعل الحديد مع محلول حامض الكبريتيك ، تتشكل كبريتات الحديد (II) FeSO 4 والهيدروجين. لاحظ أنه في كلا التفاعلين ، يتم إطلاق الهيدروجين من المحلول ، كما هو موضح بالسهم.
أرز. 1. تفاعل الحديد مع حمض الهيدروكلوريك

أرز. 2. تفاعل الحديد مع محلول حامض الكبريتيك
التفاعلات المذكورة أعلاه من نوع الاستبدال. في كل من هذه التفاعلات ، تدخل مادة بسيطة واحدة ومادة معقدة واحدة ، ويتكون مركب جديد بسيط وجديد. تسمى ردود الفعل هذه ردود فعل الاستبدال.
يمكن لبعض المعادن أن تحل محل الهيدروجين في الأحماض.
لذلك فإن الأحماض عبارة عن مواد تحتوي على الهيدروجين ويمكن استبدالها بالمعادن.
يأتي اسم "الهيدروجين" من اليونانية. كلمات "جيدور" - ماء و "جناو" - ألد أي. "تلد الماء". في الواقع ، عندما يتم حرق الهيدروجين ، يتكون الماء. تم اقتراح هذا الاسم من قبل A.Lavoisier في عام 1779.
الهيدروجين هو العنصر الكيميائي الأكثر وفرة في الكون وهو المكون الرئيسي للنجوم. يعتبر عنصر الهيدروجين الكيميائي جزءًا من جميع النباتات والحيوانات ، بالإضافة إلى تكوين المادة الأكثر شيوعًا على الأرض - الماء.
مادة الهيدروجين البسيطة لها الصيغة H 2. وهي مادة غازية ، لا طعم لها ورائحة ، قليل الذوبان في الماء. درجة غليان الهيدروجين هي -253 درجة مئوية. الهيدروجين هو الأخف وزنا من بين جميع المواد الغازية ، فهو أخف 14.5 مرة من الهواء.
2. الحصول على الهيدروجين والتحقق من نقاوته ().
العمل في المنزل
1) مع. 76-78 2،3،5،6،9من كتاب المصنف في الكيمياء: الصف الثامن: إلى الكتاب المدرسي بقلم أ. Orzhekovsky وآخرون "الكيمياء. الصف 8 "/ O.V. أوشاكوفا ، بي. بيسبالوف ، ب. أورزيكوفسكي. تحت. إد. الأستاذ. ب. Orzhekovsky - M: AST: Astrel: Profizdat ، 2006.
2) ص 140-141 رقم 2،6من الكتاب المدرسي P. Orzhekovsky ، L.M. ميشرياكوفا ، م. Shalashova "الكيمياء: الصف الثامن" ، 2013
يحتل تاريخ اكتشاف الهيدروجين معلمًا هامًا في تطور العلوم. ووفقًا للمفاهيم العلمية الحديثة ، يعد هذا الغاز من أهم المواد لوجود النجوم ، وبالتالي فهو المصدر الرئيسي للطاقة.
تاريخ موجز لاكتشاف الهيدروجين
تم اكتشاف العنصر بواسطة عالم بريطاني عام 1766. يعود أصل الاسم إلى الكلمات اليونانية "hydro" و "genes" ، والتي تعني "الماء" و "المولد".
في وقت مبكر من عام 1671 ، نشر روبرت بويل (1627-1691 ، الكيميائي والفيزيائي الإنجليزي) "تجارب جديدة بشأن العلاقة بين اللهب والهواء" وصف فيها التفاعل بين برادة الحديد والأحماض المخففة. خلال التجارب ، لاحظ العالم أن تفاعل هذه المواد يؤدي إلى تطور غاز الهيدروجين ("محلول المريخ القابل للاحتراق").
ومع ذلك ، لم تتم الموافقة على الغاز كعنصر رئيسي حتى عام 1766 من قبل هنري كافنديش (1731-1810 ، الكيميائي والفيزيائي الإنجليزي الذي اكتشف النيتروجين أيضًا) ، والذي استخدم الزئبق في التخليق. ووصفه العالم بأنه "هواء من المعادن قابل للاشتعال". وصف كافنديش خصائص الهيدروجين بدقة ، لكنه اعتقد خطأً أن الغاز أتى من معدن وليس من حمض. تم إعطاء الاسم الحديث للعنصر الكيميائي من قبل عالم الطبيعة الفرنسي أ. ل. لافوازييه.
لا ينتهي تاريخ اكتشاف الهيدروجين (H) عند هذا الحد. في عام 1931 ، اكتشف أستاذ الكيمياء هارولد أوري ، الذي كان يعمل في شيكاغو (الولايات المتحدة الأمريكية) ، غاز الديوتيريوم. إنه النظير الثقيل للهيدروجين ومكتوب بالشكل 2 H و D.

اللبنات الأساسية للكون
لفترة طويلة لم يستطع الناس فهم خصائص المادة. على الرغم من أن الإغريق القدماء افترضوا أن "الأثير" (الفضاء المحيط) يتكون من عناصر معينة ، لم يكن هناك مبرر واضح ، وأكثر من ذلك ، دليل قوي على هذه الحقيقة.
في خريف عام 1803 ، تمكن الإنجليزي من شرح نتائج بعض أبحاثه بافتراض أن المادة تتكون من ذرات. وجد الباحث أيضًا أن جميع عينات أي مركب معين تتكون من نفس المجموعة من هذه الذرات. لاحظ دالتون أيضًا أنه في عدد من المركبات ، يمكن اختزال نسب كتل العنصر الثاني ، والتي يتم دمجها مع وزن معين للعنصر الأول ، إلى أعداد صحيحة صغيرة ("قانون النسب المتعددة"). وبالتالي ، فإن للعالم علاقة معينة بتاريخ اكتشاف الهيدروجين.
تم تقديم "نظرية الذرات" لدالتون في المجلد الثالث من الطبعة العلمية "أنظمة الكيمياء" ، التي نشرها توماس طومسون في عام 1807. ظهرت المادة أيضًا في مقال عن أكسالات السترونتيوم نُشر في Philosophical Transactions. في العام القادمنشر دالتون هذه الأفكار بمفرده ، وقام بتحليل أكثر شمولاً في النظام الجديد للفلسفة الكيميائية. بالمناسبة ، اقترح العالم فيه استخدام دائرة بها نقطة في المركز كرمز للهيدروجين.
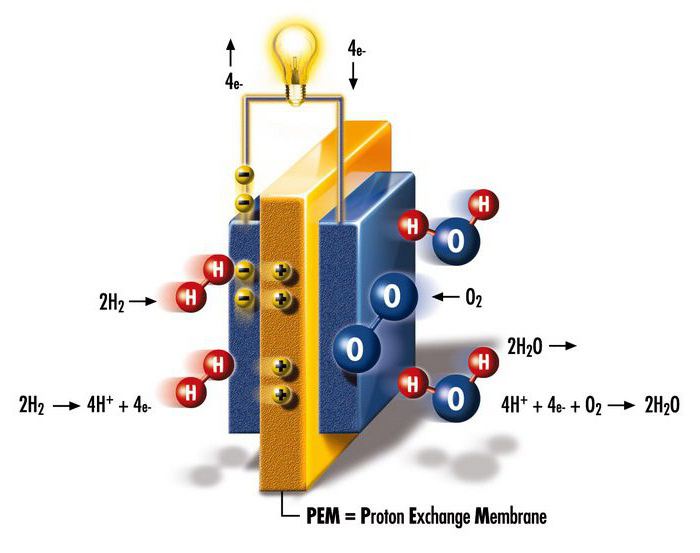
أول خلية وقود
تاريخ اكتشاف الهيدروجين غني بالأحداث المثيرة للاهتمام. في عام 1839 ، أجرى العالم البريطاني السير ويليام روبرت جروف تجارب على التحليل الكهربائي. استخدم الكهرباء لتقسيم الماء إلى هيدروجين وأكسجين. فيما بعد ، تساءل الباحث عما إذا كان من الممكن القيام بالعكس - لتوليد الكهرباء من تفاعل الأكسجين مع الهيدروجين؟ ختم جروف سجلات البلاتين في حاويات منفصلة مختومة ، تحتوي إحداها على الهيدروجين والأكسجين. عندما غُمرت الحاويات في حمض الكبريتيك المخفف ، تدفق تيار بين القطبين ، مكونًا الماء في أسطوانات الغاز. ثم قام العالم بتوصيل عدة أجهزة مماثلة في دائرة متسلسلة لزيادة الجهد الناتج في بطارية الغاز.
منذ ذلك الحين ، علقت آمال كبيرة على الهيدروجين فيما يتعلق بالحصول على مصادر طاقة مدمجة وصديقة للبيئة. ومع ذلك ، لم يتم حل مشكلة الأمان بنسبة 100٪ والكفاءة العالية للأجهزة الطرفية للاستهلاك الشامل. بالمناسبة ، مصطلح "خلية الوقود" استخدم لأول مرة من قبل الكيميائيين لودفيج موند وتشارلز لانجر ، الذين واصلوا بحث دبليو آر جروف.
مصادر الطاقة المستقلة
في عام 1932 ، واصل فرانسيس توماس بيكون ، وهو مهندس في جامعة كامبريدج في المملكة المتحدة ، العمل على تصاميم Grove و Mond و Langer. استبدل أقطاب البلاتين بشبكة نيكل أقل تكلفة ، وبدلاً من إلكتروليت بحمض الكبريتيك ، استخدم هيدروكسيد البوتاسيوم القلوي (أقل تآكلًا للأقطاب الكهربائية). كان هذا في الأساس إنشاء أول خلية وقود قلوية ، تسمى خلية بيكون. استغرق البريطانيون 27 عامًا أخرى لإثبات وجود مصنع قادر على إنتاج 5 كيلوواط من الطاقة ، وهو ما يكفي لتشغيل آلة لحام. في نفس الوقت تقريبًا ، تم عرض أول سيارة تعمل بخلايا الوقود.
استخدمت ناسا لاحقًا خلايا الوقود في الستينيات لبرنامج أبولو القمري. كانت خلايا بيكون (ولا تزال) على مئات المركبات الفضائية. كما تستخدم "البطاريات الكبيرة" في الغواصات.

مفيد ولكنه خطير
لا يرتبط تاريخ اكتشاف الهيدروجين باللحظات السعيدة فقط. تشهد مأساة المنطاد العملاق هيندنبورغ على مدى خطورة هذا العنصر. في الثلاثينيات من القرن الماضي ، قامت ألمانيا ببناء سلسلة من الطائرات - زيبلين. تم استخدام الهيدروجين كغاز. نظرًا لكونه أخف من خليط النيتروجين والأكسجين الذي يشكل الجزء الأكبر من الغلاف الجوي ، فقد جعل من الممكن نقل كميات كبيرة من البضائع.
في عام 1936 ، قدم المصممون الألمان إلى العالم أكبر منطاد في ذلك الوقت ، هيندنبورغ. احتوى العملاق البالغ طوله 245 مترا على 200 ألف متر مكعب من الغاز. قدرتها الاستيعابية مذهلة: كان الجهاز قادرًا على رفع ما يصل إلى 100 طن من البضائع إلى السماء. تم استخدام الطائرة للنقل عبر المحيط الأطلسي بين ألمانيا والولايات المتحدة. استوعب جندول الركاب 50 شخصًا مع أمتعة. 05/06/1937 عند الوصول إلى نيويورك ، حدث تسرب للهيدروجين. اشتعل الغاز القابل للاشتعال ، مما تسبب في انفجار أدى إلى مقتل 36 شخصًا. منذ ذلك الحين ، تم استخدام الهليوم الأكثر أمانًا بدلاً من الهيدروجين في الطائرات.
خاتمة
الهيدروجين هو واحد من العناصر الأساسيةفي الكون. على الرغم من أن خصائصه مدروسة جيدًا ، إلا أنها لا تتوقف عن اهتمام العلماء والمهندسين والمصممين. هذا العنصر هو موضوع آلاف الأوراق العلمية والدبلومات والملخصات. تاريخ اكتشاف الهيدروجين هو تاريخ العلم نفسه ، نظام معرفي حل محل الجهل والمعتقدات الدينية.
1تاريخ اكتشاف الهيدروجين. الخصائص الفيزيائية والكيميائية. طرق انتاج الهيدروجين.
شعار درس:
لكي تصبح كيميائيًا حقيقيًا ، عليك أن تعرف ، وتكون قادرًا ، وتفكر! "

نقوش الدرس:
"لمن يعرف القليل
وهذا كثير
ولأولئك الذين يريدون معرفة الكثير
وهذا لا يكفي "


أسئلة:
حول اكتشاف الغاز قيد البحث.
من اكتشف هذا الغاز؟
ما هي الخصائص الفيزيائية المميزة لـ O2 المذكورة في القصيدة.
ما هي المواد التي تتشكل أثناء الأكسدة (الأكاسيد).
ما هو الأكسيد؟
ما هو الأكسيد الذي تم استخدامه لاكتشاف الأكسجين؟

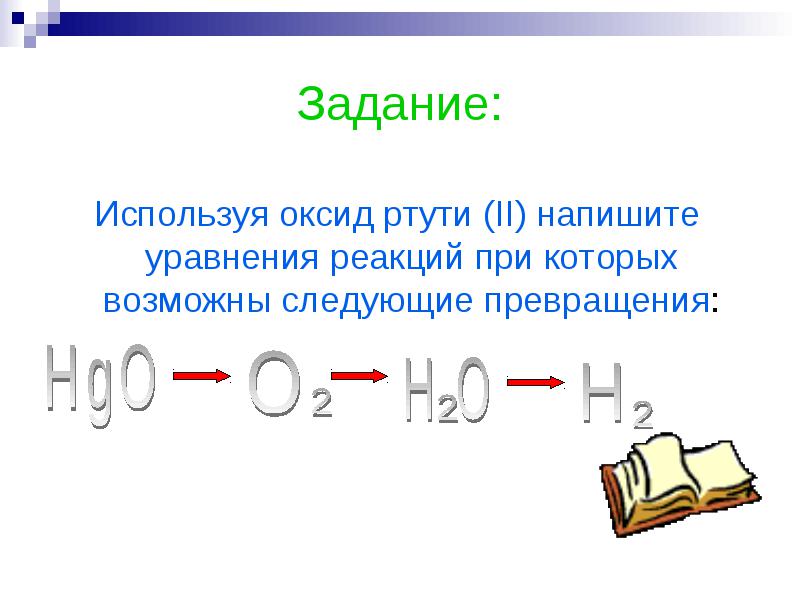
يمارس:
باستخدام أكسيد الزئبق الثنائي ، اكتب معادلات التفاعل التي يمكن من أجلها إجراء التحولات التالية:
تحقق من نفسك:
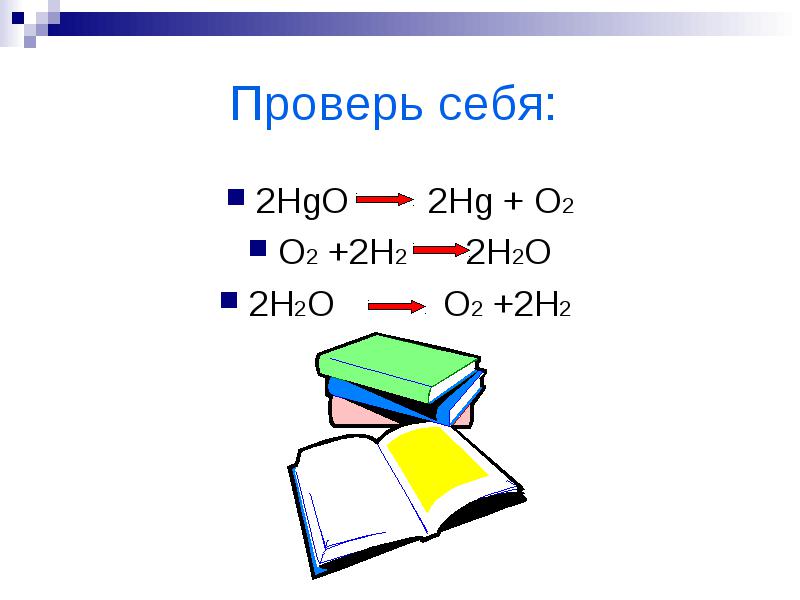
2HgO 2Hg + O2
O2 + 2H2 2H2O
2H2O O2 + 2H2
.
هدف:
تعرف على توزيع الهيدروجين في الطبيعة
تعرف على تاريخ اكتشاف الهيدروجين
دراسة الخصائص الفيزيائية والكيميائية للهيدروجين بالمقارنة مع الأكسجين
ضع في اعتبارك التطبيقات الرئيسية للهيدروجين


قشرة الأرض
(جزء الشامل)



التوزيع على الأرض.
الماء - H2O
الميثان - كبريتيد الهيدروجين CH4 -
التوزيع في الكون
الهيدروجين هو العنصر الأكثر وفرة في الكون.
يمثل حوالي 92٪ من جميع الذرات
(8٪ ذرات هيليوم ، وحصة جميع العناصر الأخرى مجتمعة أقل من 0.1٪).
الهيدروجين هو المكون الرئيسي للنجوم والغاز بين النجوم.
في درجات الحرارة النجمية ، يوجد الهيدروجين على شكل بلازما ،
في الفضاء بين النجوم ، يوجد هذا العنصر في شكل جزيئات فردية وذرات وأيونات
ويمكن أن تشكل غيومًا جزيئية متفاوتة بشكل كبير في الحجم والكثافة ودرجة الحرارة.

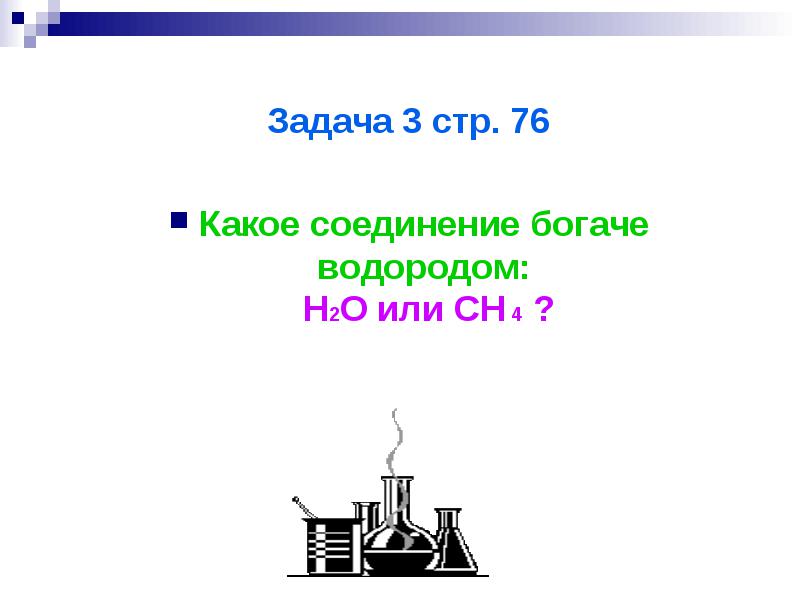
المهمة 3 صفحة 76
ما المركب الأكثر ثراءً بالهيدروجين: H2O أم CH4؟
اختبر نفسك: الحل


القرن السادس عشر - وصف باراسيلسوس و ر. بويل H2. 1700 - N. Lemery - ينفجر الغاز الناتج عن عمل H2SO4 على الحديد. 1766 اكتشف ج. كافنديش H2 ووصفه بأنه "هواء قابل للاشتعال". في عام 1781 ، أثبت A. Lavoisier أن H2O هو نتاج تفاعل H2 و O2 (H2 - من اليونانية "ولادة H2O"). 1824 اقترح إم إف سولوفييف الاسم الروسي "الهيدروجين".
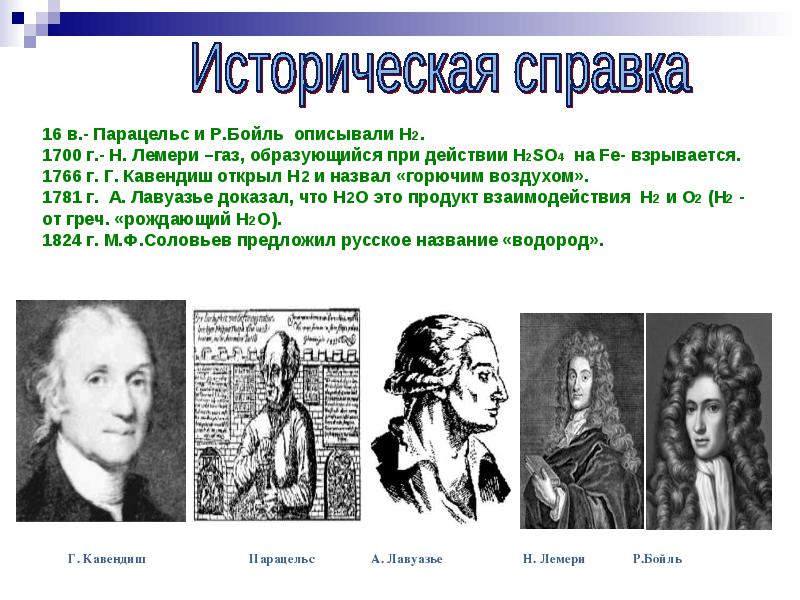
درس الفيزيائي والكيميائي الإنجليزي الشهير جي كافيديش هذا الغاز في عام 1766 وأطلق عليه اسم "الهواء القابل للاحتراق". عند الاحتراق ، أنتج "الهواء القابل للاحتراق" الماء ، لكن تمسك كافنديش بنظرية الفلوجستون منعه من استخلاص النتائج الصحيحة.

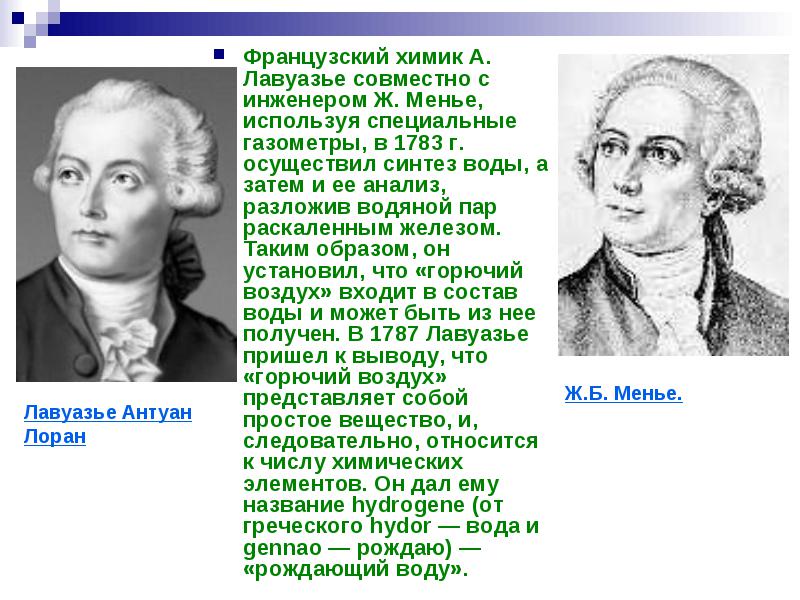
قام الكيميائي الفرنسي أ. لافوازييه ، بالاشتراك مع المهندس ج. مونييه ، باستخدام مقاييس غاز خاصة ، في عام 1783 بتركيب الماء ، ثم تحليله ، مما أدى إلى تحلل بخار الماء بالحديد الساخن. وهكذا أثبت أن "الهواء القابل للاحتراق" هو جزء من الماء ويمكن الحصول عليه منه. في عام 1787 ، توصل لافوازييه إلى استنتاج مفاده أن "الهواء القابل للاحتراق" مادة بسيطة ، وبالتالي فهو من بين العناصر الكيميائية. أطلق عليها اسم هيدروجين (من الكلمة اليونانية hydor - ماء و gennao - تلد) - "تلد الماء".
تم تأسيس القرن
اقترح الكيميائي M.F. Solovyov الاسم الروسي "الهيدروجين" في عام 1824. في مطلع القرنين الثامن عشر والتاسع عشر ، وجد أن ذرة الهيدروجين خفيفة جدًا (مقارنة بذرات العناصر الأخرى) ، وتم أخذ وزن (كتلة) ذرة الهيدروجين كوحدة لمقارنة الكتل الذرية من العناصر. تم تخصيص كتلة ذرة الهيدروجين بقيمة تساوي 1.

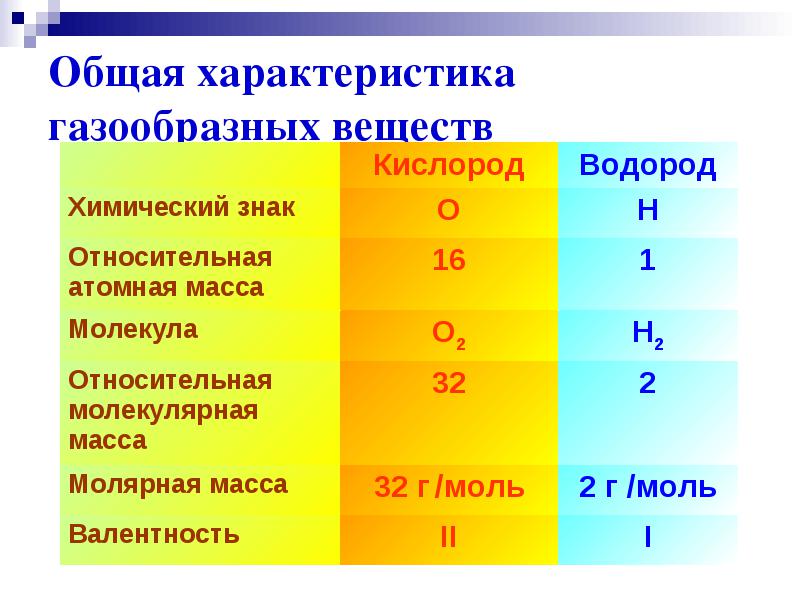
الخصائص الفيزيائية للهيدروجين
جزيء الهيدروجين ثنائي الذرة - H 2 .
في الظروف العادية ، يكون غازًا عديم اللون والرائحة والمذاق.
الكثافة 0.08987 جم / لتر (NO) ،
نقطة الغليان −252.76 درجة مئوية ،
قليل الذوبان في الماء - 18.8 مل / لتر.
م (H 2 ) = 2 جم / مول
التكافؤ الأول


الخصائص العامة للمواد الغازية
دقيقة التربية البدنية

الألغاز:
أخف غاز في العالم
وهي في المجرة.
في منطاد به غاز
يمكنك أن تطير إلى النجوم.
_____________________________
لا يمكننا العيش بدونها
سوف يساعدنا دائمًا جميعًا.
هو في كل مكان -
سواء على الأرض أو في الماء.
من منكم سيخبرني
ما اسم هذا الغاز؟
____________________________
في معبد مندليف
أنا أعيش في الطابق العلوي
في ممرات مختلفة
لدي شقتين.
وهو رقم واحد!
هذا هو نوع سيدي أنا!

جهاز كيب


تفاعل الزنك مع حمض الهيدروكلوريك




ميزات التعامل مع الهيدروجين
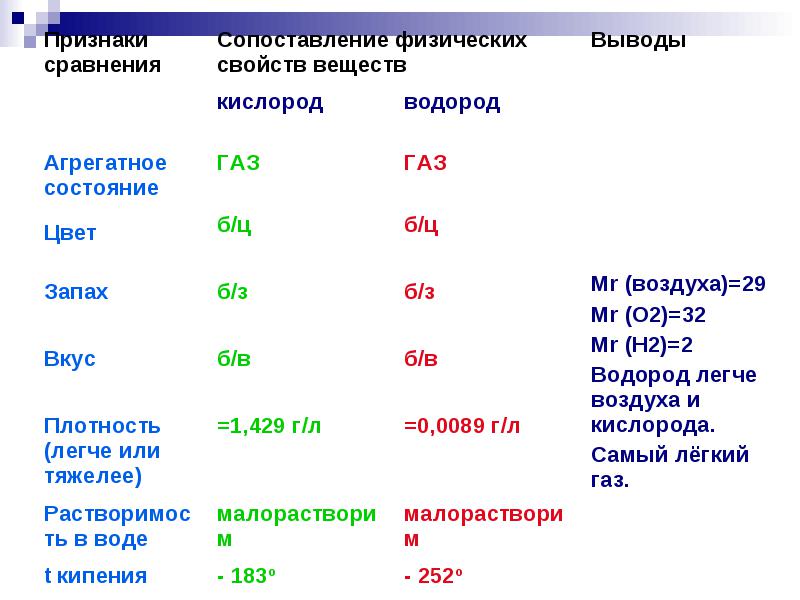
عندما يخلط الهيدروجين بالهواء ، فإنه يشكل خليطًا متفجرًا - ما يسمى بغاز التفجير.
أكبر خطر انفجار عند نسبة حجم الهيدروجين والأكسجين 2: 1 ،
أو الهيدروجين والهواء تقريبًا 2: 5
الهيدروجين قابل للاشتعال أيضا.
يمكن أن يسبب الهيدروجين السائل قضمة صقيع شديدة إذا لامست الجلد.
تحدث التركيزات المتفجرة للهيدروجين مع الأكسجين من 4٪ إلى 96٪ من حيث الحجم.
عند مزجه مع الهواء من 4٪ إلى 75 (74)٪ بالحجم.

Andrei Dmitrievich Sakharov 21 مايو 1921-14 ديسمبر 1989

الإملاء الكيميائي:
عدد 8 أسطر في عمود. اكتب معادلة الغاز المطلوب بجانب كل رقم.
1. الغاز الخفيف
2. الغاز الثقيل
3. الغاز الداعم للاحتراق
4. الغاز ، عند مزجه بالأكسجين ، ينفجر في الظروف العادية.
5. جمع عن طريق الإزاحة من الهواء.
6. مجمعة في وعاء مقلوب
7. الحصاد عن طريق إزاحة المياه.
8. مجمعة في إناء يوضع في القاع.

الإجابات الصحيحة:
1) درجات H2:
2) O2 "5" -10-9 ثقوب.
3) O2. "4" - 8-7 ثقوب.
4) H2 "3" - 6-4 ثقوب.
5) H2 ، O2.
6) H2.
7) O2 ، H2
8) O2.


امتحان:
امتحان:
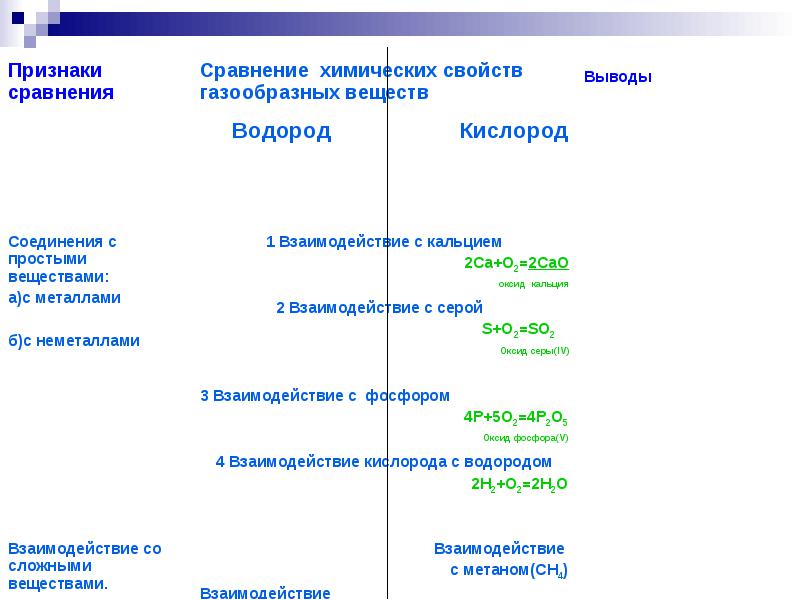
1. قارن الغازات وخصائصها:
أ) الهيدروجين 1) يشارك في عمليات الاحتراق والتنفس بحد ذاته
ب) الأكسجين 2) أخف الغازات في تفاعله مع الأكسجين
يشكل الماء.
_______________________________________________________
2. أي من خصائص الهيدروجين التالية فيزيائية:
أ) أخف الغازات.
ب) ليس له رائحة ولون.
ب) يحترق بلهب ساطع ؛
د) قليل الذوبان في الماء.
____________________________________________________________
3 - لخصائص التفجير خليط يتكون من:
أ) الأكسجين والهيدروجين.
ب) الأكسجين والنيتروجين.
ب) ثاني أكسيد الكربون والأكسجين
د) الهيدروجين وثاني أكسيد الكربون.

الإجابات الصحيحة:
1 - الدرجات ألف -2:
B-1 "5" - 6 ثقوب.
___________ "4" -5-4 ثقوب.
2. A ، B ، G "3" -3 ثقوب.
____________
المهمة غامضة.
تم تأجيل جميع التجارب
الحسابات متقطعة
في الصباح في رحلة طويلة
عالم ذاهب
وفجأة…
القبعة ملقاة في الزاوية!
يندفع إلى الطاولة!
يكتب على أي شيء
لا يمكنني سماع أي شيء.
امنع حدوث انفجار رهيب ".
ماذا كتب العالم لزملائه في هذه الرسالة؟

المهمة لغز
S S D O D A S K I S
M E V O R O D O R O L
CH A T A M O M I L I
V Y R Z V X U D Z O V.

تحقق من نفسك:
"خليط من الهيدروجين والأكسجين
أو المتفجرات الجوية.


ص 25-27 ؛
ص 25-27 ؛
تمرين 5،9 صفحة 77
مهمة إبداعية "لماذا يسمى الهيدروجين وقود المستقبل؟"
اكتب ألغازًا عن الهيدروجين.






