– это газ, важное значение которого в существовании жизни на планете началось еще миллиарды лет назад. По современным догадкам, водород (H2) появился около 14 миллиардов лет назад. Он не обладает цветом или запахом, а также является самым легким элементом периодической системы химических элементов, имея атомную массу 1.00794. Водород имеет гексагональную кристаллическую структуру и при 0° по Цельсию его плотность составляет 0.09099 г/л.
Можно считать «аристократическим» газом, так как он был открыт в 1766 году британским философом, физиком и химиком дворянского происхождения Генри Кавендишем, а свое название он получил в 1783 году благодаря французскому физику, также дворянского происхождения, Антуану Лавуазье. Лорд Кавендиш предпочитал называть свое открытие –«горючий воздух». Фантастически богатый Лорд Каведиш был настолько застенчивым и замкнутым, что в одном из его имений даже была установлена отдельная лестница на вход по причине того, что он не мог общаться со слугами, особенно женского пола, с которыми он был особенно стеснителен и общался только с помощью записок. По современным предположениям Генри Кавендиш страдал синдромом Аспергера.
Что касается Антуана Лавуазье, то его конец был печален: после всех важных научных трудов он был лишен французскими крестьянами головы с помощью гильотины во время Французской революции. Спустя несколько недель после случившегося, они признали свою ошибку и принесли извинения семье Антуана Лавуазье, а позже даже воздвигли статую в его честь. Но из-за недостатка средств, к статуи Лавуазье приделали голову другого господина. Это кажется весьма ироничным, не правда ли?
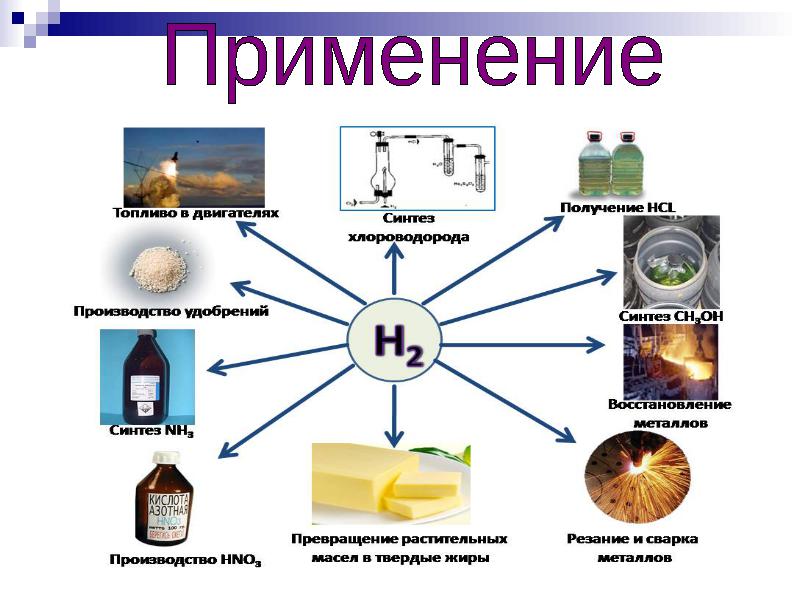
Адаптивность просто поражает. Водород способен производить электричество, поэтому он используется в топливных элементах и, будучи наиболее чистым вариантом, в двигателях внутреннего сгорания.
Водород возник в результате большого взрыва и, с тех пор, действует в самых различных сферах на Земле. За последние три с половиной миллиарда лет он активно участвует в производстве воды, а также рождении и поддержании клеточной жизни.
На сегодняшний день водород (Н2) находится под пристальным вниманием в медицинских исследованиях. Сотни научных исследований доказали терапевтический потенциал воды, обогащенной водородом, для более, чем 140 моделей различных болезней.
Вот краткий обзор некоторых терапевтических возможностей водорода и водородной воды:
- снижает поверхностное натяжение клеток, позволяя им лучше поглощать питательные вещества.
- Это самый маленький , обладающий высокой биодоступностью.
- Водород ликвидирует только самые разрушительные , превращая их в безопасную воду без каких-либо токсичных отходов.
- усиливает действие таких антиоксидантов, как глутатион и супероксиддисмутаза.
- помогает в осуществлении правильной гидратации клеток.
- Водородная вода способствует уменьшению молочной кислоты и, таким образом, избавляет от боли в мышцах во время и после физических тренировок.
- способствует производству АТФ в митохондриях.
- Водородная вода усиливает функцию митохондрий в головном мозге, улучшая тем самым мозговую активность. Также поддерживает баланс сахара и холестерина.
- Водородная вода обладает противовоспалительным действием и защищает от вредного воздействия радиации. Поэтому употребление назначают космонавтами во время полета.
- оказывает противоаллергенное действие.
Читайте статью
С древних времен людям были известны вещества, способные растворять некоторые металлы. Слабые растворы этих веществ имеют кислый вкус, поэтому их назвали «кислоты». Например, лимонная кислота содержится в лимоне, яблочная кислота - в яблоке. Вещество с химической формулой H 2 SO 4 называется серной кислотой.
Многие исследователи проводили опыты с кислотами. Было замечено, что при действии кислот на некоторые металлы выделяются пузырьки газа. Полученный газ легко воспламенялся, и его назвали «горючим воздухом».
Подробно свойства этого газа были изучены английским ученым Г. Кавендишем в 1766г. Он помещал металлы в растворы серной и соляной кислот и во всех случаях получал одно и то же легкое газообразное вещество, которое позже назвали водородом.
Приведем примеры уравнений реакций взаимодействия металла с кислотой, в ходе которых образуется водород. При взаимодействии железа с соляной кислотой образуется хлорид железа (II) и водород. При взаимодействии железа с раствором серной кислоты образуется сульфат железа (II) FeSO 4 и водород. Обратите внимание, в обеих реакциях водород выделяется из раствора, что показано с помощью стрелки.
Рис. 1. Взаимодействие железа с соляной кислотой

Рис. 2. Взаимодействие железа с раствором серной кислоты
Приведенные реакции относятся к типу замещения. В каждую из этих реакций вступает одно простое вещество и одно сложное вещество, и образуется новое простое и новое сложное. Такие реакции и называются реакциями замещения.
Некоторые металлы могут замещать водород в кислотах.
Поэтому, кислотами называют вещества, в состав которых входит водород, способный замещаться металлами.
Название «водород» происходит от греч. слов «гидор» - вода и «генао» - рождаю, т.е. «рождающий воду». Действительно, при горении водорода образуется вода. Это название предложил А. Лавуазье в 1779 г.
Водород является самым распространенным химическим элементом Вселенной, из него в основном состоят звезды. Химический элемент водород входит в состав всех растений и животных, а также в состав самого распространенного вещества на Земле - воды.
Простое вещество водород имеет формулу Н 2 . Это газообразное вещество, без вкуса и запаха, малорастворимое в воде. Температура кипения водорода -253°С. Водород - самый легкий из всех газообразных веществ, он в 14,5 раз легче воздуха.
2. Получение водорода и проверка его на чистоту ().
Домашнее задание
1) с. 76-78 №№ 2,3,5,6,9 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
2) с.140-141 №№ 2,6 из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
История открытия водорода занимает важную веху в развитии науки. Согласно современным научным представлениям, этот газ - один из Он является наиболее важным веществом для существования звезд, а, следовательно, главным источником энергии.
Краткая история открытия водорода
Элемент был обнаружен британским ученым в 1766 году. Происхождение названия восходит к греческим словам «гидро» и «генов», что означает «вода» и «генератор».
Еще в 1671 году Роберт Бойл (1627-1691, английский химик и физик) опубликовал статью «Новые эксперименты, касающиеся отношения между пламенем и воздухом», в которой он описал реакцию между железными опилками и разбавленными кислотами. В процессе экспериментов ученый заметил, что реакция данных веществ приводит к эволюции газообразного водорода («горючий раствор Марса»).
Однако только в 1766 году газ был утвержден в качестве основного элемента Генри Кавендишем (1731-1810, английский химик и физик, который также открыл азот), использовавшим для синтеза ртуть. Ученый охарактеризовал его как «легковоспламеняющийся воздух из металлов». Кавендиш точно описал свойства водорода, но ошибочно считал, что газ происходит от металла, а не от кислоты. Современное название химическому элементу дал французский естествоиспытатель А. Л. Лавуазье.
История открытия водорода (H) на этом не заканчивается. В 1931 году профессором химии Гарольдом Юри, работавшим в Чикаго (США), был обнаружен газ дейтерий. Он является тяжелым изотопом водорода и записывается как 2 H и D.

Кирпичики мироздания
Долгое время люди не могли разобраться в свойствах материи. Хотя еще древние греки предполагали, что «эфир» (окружающее пространство) состоит из неких элементов, четкого обоснования и тем более твердых доказательств сему факту не существовало.
Осенью 1803 года англичанин смог объяснить результаты некоторых своих исследований, предположив, что вещество состоит из атомов. Также исследователь выяснил, что все образцы любого данного соединения состоят из одной и той же комбинации этих атомов. Дальтон также отметил, что в ряде соединений отношения масс второго элемента, которые сочетаются с заданным весом первого элемента, могут быть сведены к малым целым числам («Закон множественных пропорций»). Таким образом, ученый имеет определенное отношение к истории открытия водорода.
Презентация «Теории атомов» Дальтона состоялась в 3-м томе научного издания «Системы химии», изданном Томасом Томсоном в 1807 году. Также материал появился в статье об оксалатах стронция, опубликованной в «Философских транзакциях». В следующем году Дальтон самостоятельно опубликовал эти идеи, сделав более развернутый анализ в работе «Новая система химической философии». Кстати, в ней ученый предложил использовать в качестве символа водорода круг с точкой в центре.
Первый топливный элемент
История открытия водорода богата интересными событиями. В 1839 году британский ученый сэр Уильям Роберт Гроув провел эксперименты по электролизу. Он использовал электричество для разделения воды на водород и кислород. Позже исследователь задумался, а можно ли сделать обратное действие - генерировать электричество из реакции кислорода с водородом? Гроув закрыл платиновые пластинки в отдельных запечатанных емкостях, в одной из которых содержался водород, а в другой - кислород. Когда контейнеры были погружены в разбавленную серную кислоту, между двумя электродами потек ток с образованием воды в газовых баллонах. Затем ученый связал несколько подобных устройств в последовательную цепь, чтобы увеличить напряжение, создаваемое в газовой батарее.
С тех пор на водород возлагаются большие надежды в плане получения компактных экологически чистых источников энергии. Однако пока не решен вопрос 100 %-й безопасности и высокой эффективности конечных устройств для массового потребления. Кстати, термин «топливный элемент» впервые использован химиками Людвигом Мондом и Чарльзом Лангером, продолжившими исследования У. Р. Гроува.
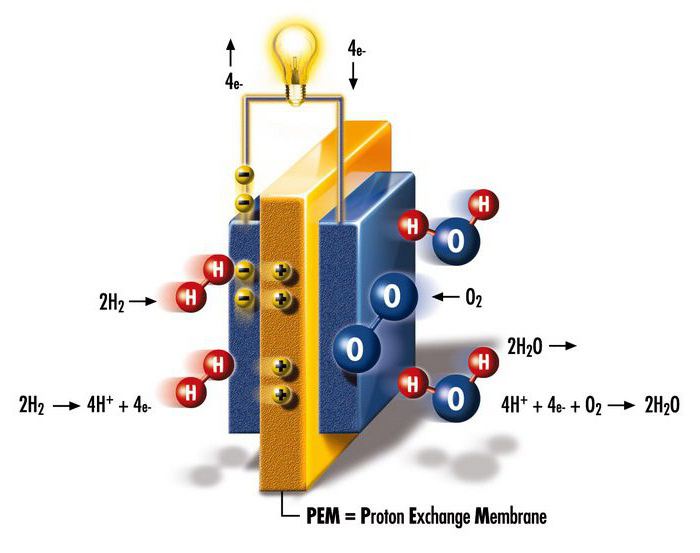
Автономные источники энергии
В 1932 году Фрэнсис Томас Бэкон, инженер Кембриджского университета в Великобритании, продолжил работу над проектами Гроува, Монда и Лангера. Он заменил платиновые электроды менее дорогой никелевой сеткой, а вместо электролита с серной кислотой использовал щелочной гидроксид калия (менее агрессивный к электродам). Это было по существу создание первого щелочного топливного элемента, получившего название ячейка Бэкона. Британцу потребовалось еще 27 лет, чтобы продемонстрировать установку, способную производить 5 кВт энергии, что достаточно для питания сварочного аппарата. Примерно в то же время был продемонстрирован первый автомобиль на топливных элементах.
Позже топливные элементы использовались НАСА в 1960 годах для полетов в рамках лунной программы «Аполлон». Ячейки Бэкона стояли (и стоят) на сотнях космических аппаратов. Также «большие батарейки» используются на подводных лодках.

Полезный, но опасный
История открытия водорода сопряжена не только с радостными моментами. О том, насколько небезопасен данный элемент, свидетельствует трагедия дирижабля-гиганта «Гинденбург». В 1930 годах Германия построила серию воздушных судов - цеппелинов. В качестве газа использовался водород. Будучи легче азотно-кислородной смеси, составляющей основную часть атмосферы, он позволял перевозить большие объемы грузов.
В 1936 году немецкие конструкторы представили миру крупнейший на то время дирижабль «Гинденбург». 245-метровый гигант вмещал 200000 м3 газа. Его грузоподъемность поразительна: аппарат был способен поднять в небо до 100 тонн грузов. Воздушное судно использовалось для трансатлантических перевозок между Германией и США. Пассажирская гондола вмещала 50 человек с багажом. 6.05.1937 по прибытии в Нью-Йорк произошла утечка водорода. Легко воспламеняющийся газ загорелся, произошел взрыв, приведший к смерти 36 человек. С тех пор вместо водорода в летательных аппаратах применяют более безопасный гелий.
Вывод
Водород - один из важнейших элементов во Вселенной. Хотя его свойства хорошо изучены, он не перестает интересовать ученых, инженеров, конструкторов. Данный элемент является темой тысяч научных работ, дипломов и рефератов. История открытия водорода - это история самой науки, системы знаний, пришедшей на смену невежеству и религиозным догмам.
1История открытия водорода. Физические и химические свойства. Способы получения водорода.
ДЕВИЗ УРОКА:
Чтобы стать настоящим химиком , надо знать, уметь, думать!"

Эпиграф урока:
«Для тех, кто мало знает
и этого много,
а для тех, кто хочет знать много
и этого мало»


Вопросы:
Об открытии , какого газа идёт речь.
Кто открыл этот газ?
О каких физических свойствах характерных для О2 говорится в стихотворении.
Какие вещества образуются при окислении (оксиды).
Что называется оксидами?
Какой оксид был использован для открытия кислорода?

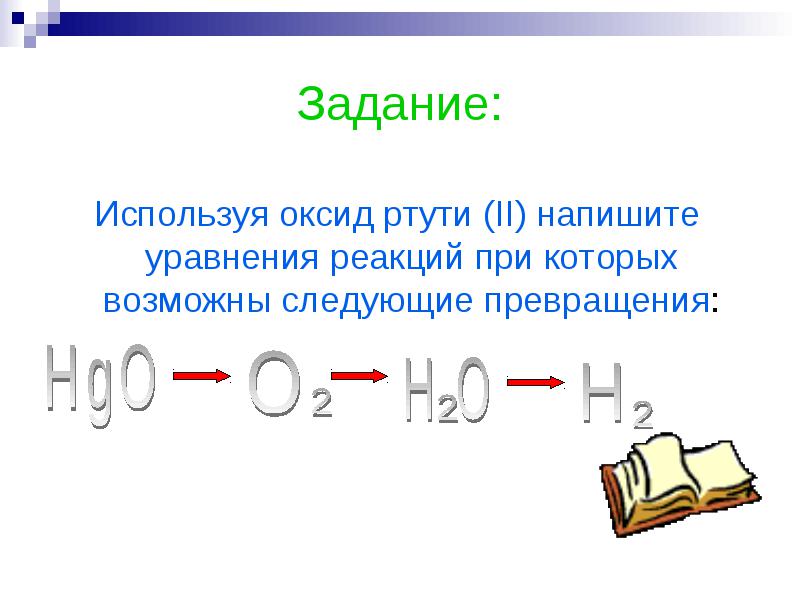
Задание:
Используя оксид ртути (II) напишите уравнения реакций при которых возможны следующие превращения:
Проверь себя:
2HgO 2Hg + O2
O2 +2H2 2H2O
2H2O O2 +2H2
.
Цель:
Познакомиться с распространением водорода в природе
Познакомиться с историей открытия водорода
Изучить физические и химические свойства водорода в сравнении с кислородом
Рассмотреть основные области применения водорода


Земная кора
(массовая доля)



Распространение на Земле.
Вода – Н2О
Метан - CH4 Сероводород-
Распространённость во Вселенной
Водород - самый распространённый элемент во Вселенной .
На его долю приходится около 92 % всех атомов
(8 % составляют атомы гелия, доля всех остальных вместе взятых элементов - менее 0,1 %).
водород - основная составная часть звёзд и межзвёздного газа.
В условиях звёздных температур водород существует в виде плазмы ,
в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов
и может образовывать молекулярные облака, значительно различающиеся по размерам , плотности и температуре.

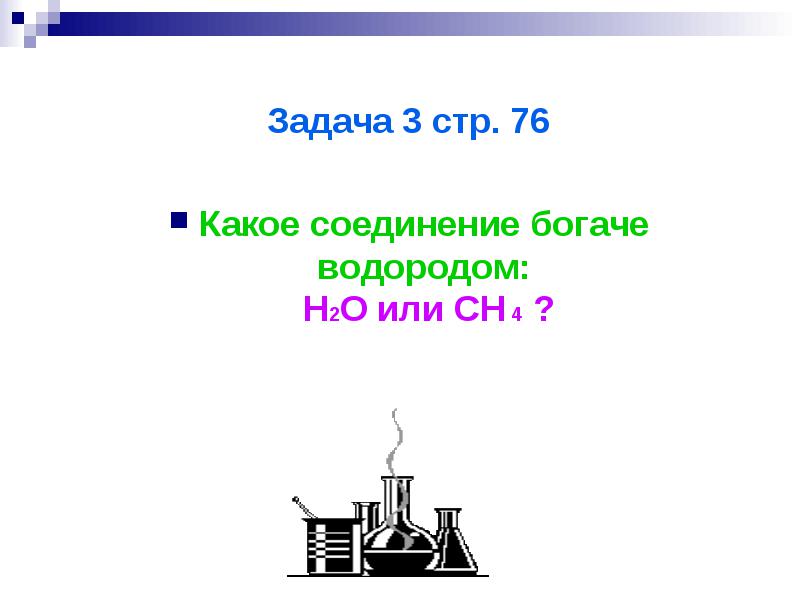
Задача 3 стр. 76
Какое соединение богаче водородом: H2O или CH 4 ?
Проверь себя: Решение


16 в.- Парацельс и Р.Бойль описывали Н2. 1700 г.- Н. Лемери –газ, образующийся при действии Н2SO4 на Fе- взрывается. 1766 г. Г. Кавендиш открыл Н2 и назвал «горючим воздухом». 1781 г. А. Лавуазье доказал, что Н2О это продукт взаимодействия Н2 и О2 (Н2 - от греч. «рождающий Н2О). 1824 г. М.Ф.Соловьев предложил русское название «водород».
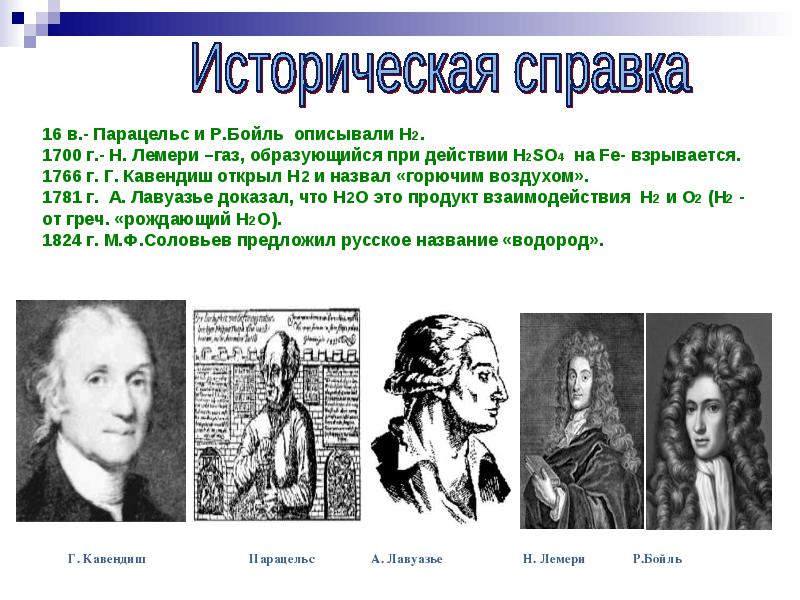
Знаменитый английский физик и химик Г.Каведиш в 1766 исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы.

Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды , а затем и ее анализ, разложив водяной пар раскаленным железом. Таким образом , он установил, что «горючий воздух» входит в состав воды и может быть из нее получен. В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество , и, следовательно, относится к числу химических элементов. Он дал ему название hydrogene (от греческого hydor - вода и gennao - рождаю) - «рождающий воду».
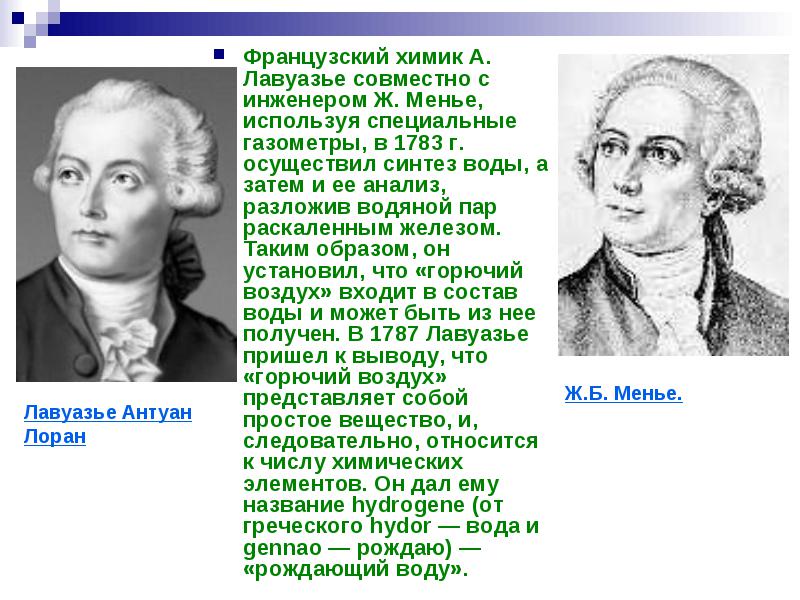
века было установлено
Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году. На рубеже 18 и 19 века было установлено , что атом водорода очень легкий (по сравнению с атомами других элементов), и вес (масса) атома водорода был принят за единицу сравнения атомных масс элементов. Массе атома водорода приписали значение, равное 1.

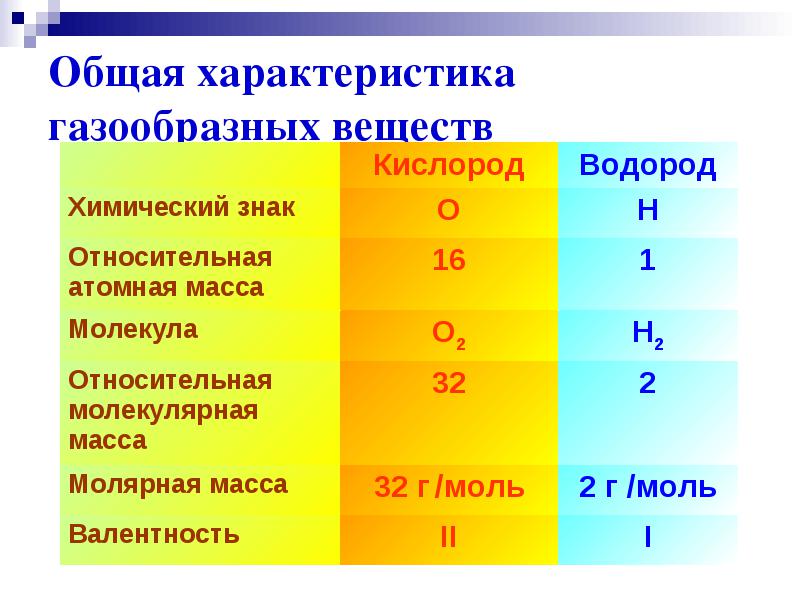
Физические свойства водорода
Молекула водорода двухатомна - Н2 .
При нормальных условиях - это газ без цвета, запаха и вкуса.
Плотность 0,08987 г/л (н.у.),
Температура кипения −252,76 °C,
Малорастворим в воде - 18,8 мл/л.
M (H2 )=2г/моль
Валентность I


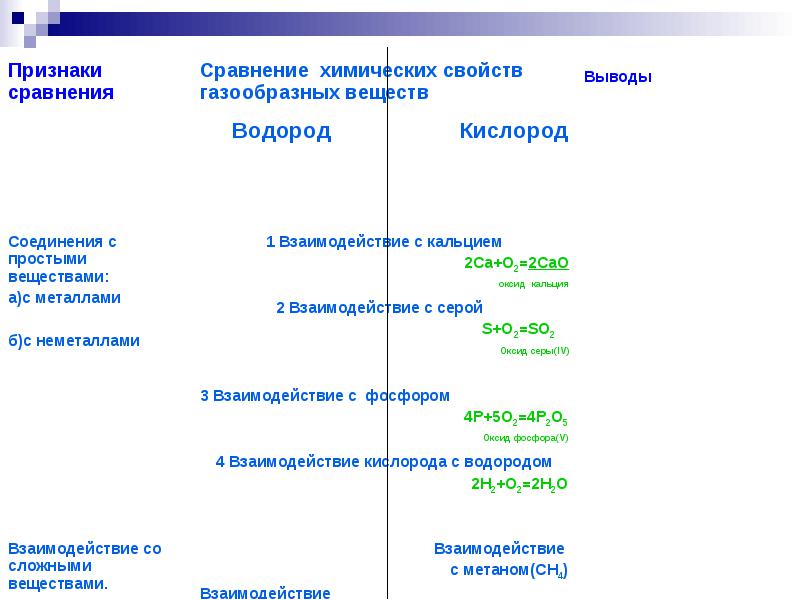
Общая характеристика газообразных веществ
Физкультминутка

Загадки:
Самый лёгкий газ на свете,
И в галактике он есть.
На воздушном шаре с газом
Можно к звёздам улететь.
_____________________________
Без него мы жить не можем ,
Он всегда нам всем поможет.
Он находится везде –
И на суше и в воде.
Кто же скажет мне из вас,
Как зовётся этот газ?
____________________________
В храме Менделеева
Наверху проживаю,
В разных подъездах
Две квартиры занимаю.
Причем – под номером один!
Вот какой я господин!

Аппарат Киппа


Взаимодействие цинка с соляной кислотой




Особенности обращения с водородом
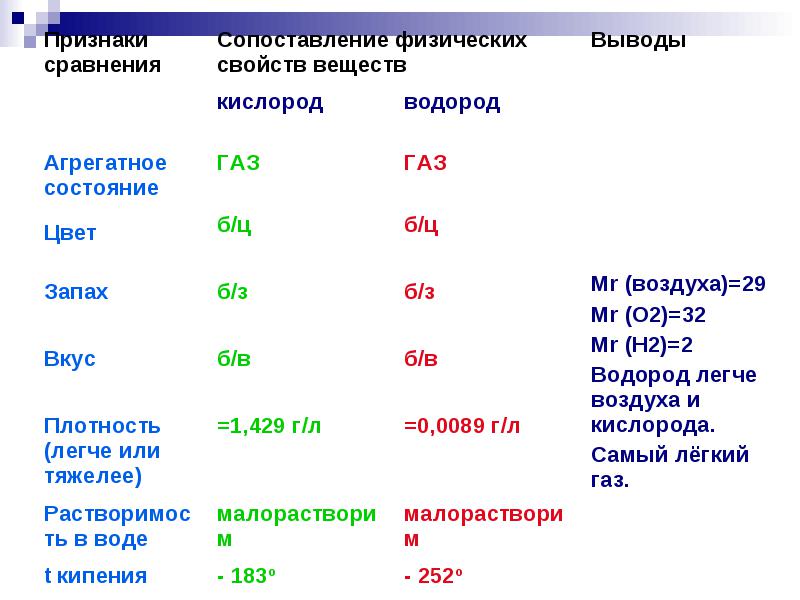
Водород при смеси с воздухом образует взрывоопасную смесь - так называемый гремучий газ.
Наибольшую взрывоопасность при объёмном отношении водорода и кислорода 2:1,
или водорода и воздуха приближённо 2:5
Также водород пожароопасен.
Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных.
При смеси с воздухом от 4 % до 75(74) % объёмных.

Андрей Дмитриевич Сахаров 21 мая 1921 г. – 14 декабря 1989 г.

Химический диктант:
Пронумеруйте 8 строчек в столбик. Записывайте возле каждого номера формулу нужного газа.
1. Легкий газ
2. Тяжелый газ
3. Газ, поддерживающий горение
4.Газ при смешивании с кислородом взрывается при обычных условиях.
5.Собирают вытеснением воздуха.
6. Собирают в опрокинутый вверх дном сосуд
7. Собирают методом вытеснения воды.
8. Собирают в сосуд, поставленный на дно.

Правильные ответы:
1) Н2 оценки:
2) О2 «5»-10-9 отв.
3) О2. «4»- 8-7 отв.
4) Н2 «3»- 6-4 отв.
5) Н2, О2.
6) Н2.
7) О2, Н2
8) О2.


Тест:
Тест:
1.Сопоставьте газы и их свойства:
А) водород 1) участвует в процессах горения и дыхания, сам
Б) кислород 2) легчайший из газов, в реакции с кислородом
образует воду.
_______________________________________________________
2. Какие из этих свойств водорода являются физическими:
А) Легчайший газ;
Б) Не имеет запаха и цвета;
В) Горит ярким пламенем;
Г) Малорастворим в воде.
____________________________________________________________
3. Взрывчатые свойства имеет смесь , состоящая из:
А) кислорода и водорода;
Б) кислорода и азота;
В) углекислого газа и кислорода;
Г) водорода и углекислого газа.

Правильные ответы:
1. А-2 оценки:
Б-1 «5»- 6 отв.
___________ «4» -5-4 отв.
2. А,Б,Г «3»-3 отв.
____________
Задание- загадка.
Все опыты отложены
Расчеты прерываются
С утра в поездку дальнюю
Ученый собирается
И вдруг…
Шляпа брошена в углу!
Он бросается к столу!
Он на чем попало пишет
Ничего вокруг не слышит:
Страшный взрыв предотвратить".
О чем писал ученый своим коллегам в этом послании?

Задание- загадка
С С Ь Д О Д А С К И С
М Е В О Р О Д О Р О Л
Ч А Т А М О О М И Л И
В Ы Р З В Х У Д З О В

Проверь себя:
"Смесь водорода с кислородом
или воздухом взрывчата".


п 25-27;
п 25-27;
Упр.5,9 стр. 77
Творческое задание «Почему Водород называют топливом будущего?»
Сочинить загадки о водороде.






